
题目列表(包括答案和解析)
7.假设体积可以相加,下列叙述正确的是 ( )
A.0.2 mol·L-1的盐酸,与等体积水混合后pH=1
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.95 ℃纯水的pH<7,说明加热可导致水呈酸性
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
6.化学基本概念是学习化学的基础,判断下列有关化学基本概念的依据正确的是 ( )
A.胶体:是否有丁达尔现象
B.氧化还原反应:元素化合价是否变化
C.电解质和非电解质:溶于水或熔融状态下能否导电
D.同分异构体:是否具有相同的相对分子质量和不同的结构
29.(16分)
(1)Cu
+ 2H2SO4 (浓)
 CuSO4
+ SO2↑+ 2H2O (2分)
CuSO4
+ SO2↑+ 2H2O (2分)
(2)品红溶液褪色 (1分)
(3)防止倒吸(1分) SO2 + H2O + 2CO32- = SO32- + 2HCO3- 或其它合理答案(2分)
(4)取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或加盐酸,加热检验是否有使品红溶液褪色的气体产生) (2分)
(5)4Fe2++O2+4H+===4Fe3++2H2O(2分) 2Fe3++Cu===2Fe2++Cu2+ (2分)
(6) Cu + H2O2+2H+ ===Cu2+ + 2H2O(2分) 84.8% (2分)
28.(16分)
 (1)
(2分)
(1)
(2分)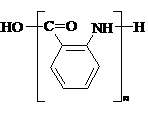 或
或 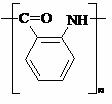 (2分)
(2分)
(2)氧化反应(2分)
(3)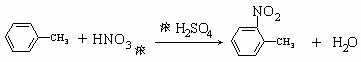 (2分)
(2分)
(4)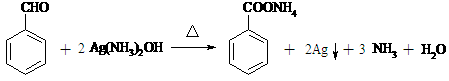 (2分)
(2分)
(5)6 (3分)
(6)
(3分)
27.(16分)(1)盐酸(2分) 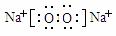 (2分)
(2分)
(2)2Al+2H2O+2OH-=2AlO2-+3H2↑(2分) Al3+ + 3AlO2-+ 6H2O == 4Al(OH)3↓(2分)
(3) 否(2分) AlCl3、NaAlO2溶液加热蒸干、灼烧,前者获得Al2O3、后者得到的仍是NaAlO2(3分)
(4)≥1 (3分):
26.(12分)(1)Cu-2e-=Cu2+(2分)、 Cu2+ + 2e-=Cu(2分) 160(2分)
(2)2AuCl4-+3SO2 + 6 H2O =2Au + 8Cl- + 3SO42- + 12H+ (3分)
(3)王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水(3分)
6.D 7.D 8.D 9.C 10.A 11.D 12.C 13.B
29.(16分)某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
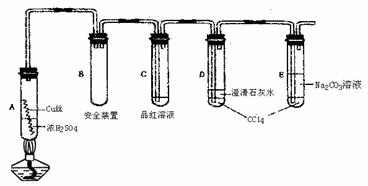
试回答下列问题:
(1)A中反应的化学方程式 。
(2)试管C中的实验现象 。
(3)D、E两支试管中CC14的作用是 ,E中反应的离子方程式为 。
(4)对A试管加热,很快C试管中观察到实验现象,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证该同学的猜想
。
(5)某研究性小组设计的由铜制取CuSO4•5H2O的实验方案如下:
方案1:空气为氧化剂法 将空气或氧气直接通入铜粉与稀硫酸的混合物中几乎不反应。在铜粉和稀硫酸的混合物中加入FeSO4或Fe2(SO4)3,并通入氧气,铜粉逐渐溶解,当铜粉完全溶解后,向其中加入某物质调节pH到3-4,产生红褐色沉淀,过滤,蒸发,结晶,得CuSO4•5H2O。[已知Fe(OH)3和Cu(OH)2完全沉淀时的PH分别为3.7和6.4]
试用离子方程式解释在铜粉和稀硫酸的混合物中加入FeSO4,并通入氧气,铜粉逐渐溶解的原因 。
方案2:将3.2 g铜丝放到45 mL 1.5 mol•L-1的稀硫酸中,控制温度在50℃。加入18 mL 10%的H2O2反应0.5 h后,升温到60℃,待反应1 h后,经过滤,蒸发结晶,减压抽滤等操作后,用少量95%的酒精淋洗并晾干,得CuSO4•5H2O 10.6 g。
该反应的离子方程式为 。
根据有关数据计算出制取CuSO4•5H2O的产率(实际产量与理论产量的百分比)
= 。
评分标准
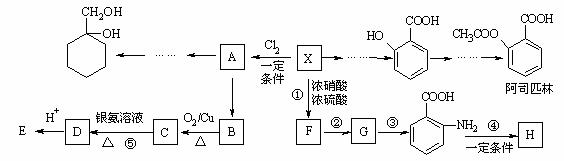
28.(16分)相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:
Ⅰ 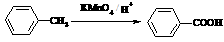
Ⅱ 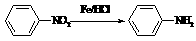 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)A的结构简式是 ,H的结构简式是
;
(2)反应②的类型是 ;
(3)反应①的化学方程式是 ;
(4)反应⑤的化学方程式是
____________________________________________;
(5)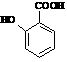 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
种;
(6)请用合成反应流程图表示出由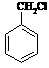 和其他无机物合成
和其他无机物合成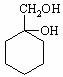 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
 例:
例:

。
27.(16分)已知下图所示各物质的转化关系中,某些反应部分产物已被省去。其中反应②用于常见金属I的冶炼,B为淡黄色固体, D、G、H均为气体且D、H无色。
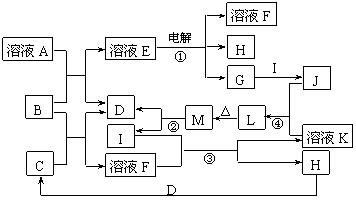

试回答下列问题:
(1)溶液A为 (写名称),B的电子式 。
(2)反应③的离子方程式 ;
反应④的离子方程式 。
(3)有同学认为M也可由溶液J或溶液K各自加热灼烧获得,试判断这种说法是否正确?
(填“是”或“否”),理由是
。
(4)若电解E、J的混合溶液,在电解开始时溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液。若要在电解后期得到澄清溶液,E和J的物质的量必须满足的关系是n(E):n(J) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com