
题目列表(包括答案和解析)
元素守恒即反应前后各元素种类不变,各元素原子个数不变,其物质的量、质量也不变。
[例题]有一在空气中放置了一段时间的KOH固体,经分析测知其含水2.8%、含K2CO337.3% 取1克该样品投入25毫升2摩/升的盐酸中后,多余的盐酸用1.0摩/升KOH溶液30.8毫升恰好完全中和,蒸发中和后的溶液可得到固体
3.(A)1克 (B)725克 (C)0.797克 (D)2.836克
[分析]KOH、K2CO3跟盐酸反应的主要产物都是KCl,最后得到的固体物质是KCl,
根据元素守恒,盐酸中含氯的量和氯化钾中含氯的量相等:
n(KCl)=n(Cl-)=n(HCl)
所以答案为B
质量守恒就是化学反应前后各物质的质量总和不变,在配制或稀释溶液的过程中,溶质的质量不变。
[例题]1500C时,碳酸铵完全分解产生气态混合物,其密度是相同条件下氢气密度的
(A)96倍 (B)48倍 (C)12倍 (D)32倍
[分析]根据质量守恒定律可知混和气体的质量等于碳酸铵的质量,从而可确定混和气体的平均分子量,混和气体密度与相同条件下氢气密度的比,所以答案为C
21.(2008年攀枝花市)现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。
[查阅资料](1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气。
(2)相对原子质量:Mg-24、Fe-56、Zn-65
[实验步骤及数据]取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
|
次数 |
1 |
2 |
3 |
4 |
|
加入稀硫酸的质量/g |
35.O |
35.0 |
35.O |
35.O |
|
剩余固体的质量/g |
6.8 |
5.6 |
4.4 |
4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
解:⑴混合物中Cu的质量分数=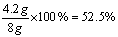 ⑵设该金属M的相对原子质量为X,第4次反应的稀硫酸质量为
⑵设该金属M的相对原子质量为X,第4次反应的稀硫酸质量为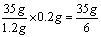
反应的总稀硫酸质量是35g×3+35/6g=665/6g
M + H2SO4=== MSO4 + H2↑
X 98
8g-4.2g 665/6g×14%
X:98=3.8g:665/6g×14% X=24
该金属是镁。
⑶设所得溶液中MgSO4的质量为y,生成H2的质量为z
Mg + H2SO4 === Mg SO4 + H2↑
98 120 2
105g×14% y z
98:120==105g×14%:y y=18g
98:2====105g×14%:z z=0.3g
MgSO4溶液的质量分数为18g/(105g+3.6g-0.3g) ×100%≈16.6%
答:该混合物粉末中铜的质量分数是52.5%;该混合物粉末中另一金属为金属镁;第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是16.6%.
20.(08年江苏)氟利昂是一种常见的制冷剂。氟利昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
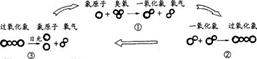
(1)请写出臭氧的化学式__ __;臭氧与氧气化学性质不同的原因是 __;
(2)经过①②③的反应后,氯原子的个数_ ___(填“减少”或“增加”或“不变”),反应①中的氯原子与反应③中的氯原子化学性质_ ___ (填“相同”或“不同”);
(3)有科学家指出:“少量的氟利昂就能对臭氧层产生巨大的影响”,请你根据循环示意图说明理由_ 。
.答案:(1)O3 结构不同 (2)不变 相同 (3)反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子能对臭氧层产生巨大影响
19.(2007 十堰)甲同学在探究酸的性质时,误把H2O2溶液当作酸与Fe2O3粉末混合,发现有大量气泡产生。他联想到MnO2可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
[猜想]Fe2O3能作为H2O2分解的催化剂。
[实验验证]甲同学依次设计了三个实验:
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二 在实验一的试管中加入WgFe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明_ _。
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为Wg。说明 _。
[实验结论]甲同学认为,粉末可以作为H2O2分解的催化剂。
[反思评价]乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。探究_ 。
[拓展]下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出什么结论?_ _。
用足量等体积H2O2溶液制取相同体积O2所需的时间:
浓度
催化剂 |
30%H2O2溶液 |
15%H2O2溶液 |
5%H2O2溶液 |
||
|
加入W g MnO2 |
0.2 |
0.8 |
2.0 |
||
|
加入W g Fe2O3 |
7.0 |
9.0 |
16.0 |
解析 催化剂的定义是能改变化学反应的速率,而本身的质量和化学性质在化学反应前后均不发生改变的物质。对于分解过氧化氢溶液制氧气的反应,Fe2O3、CuO、MnO2等都可以作为该反应的催化剂。但通过实验探究,我们可以选择催化作用更好的催化剂。
答案:Fe2O3能加快H2O2的分解速率 反应前后Fe2O3的质量保持不变 反应前后Fe2O3的化学性质是否改变(或反应前后Fe2O3是否转化为其他物质) 相同条件下,MnO2的催化效果比Fe2O3好(或其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快
18.(2007 淄博)把一小包铁粉放入一定量的硝酸铜溶液中,使其充分反应后,过滤、洗涤、干燥,得到固体。请你对固体的成分进行探究。
(1)猜想:固体的成分可能是 。
(2)实验:请设计实验验证你的猜想。说明实验过程、现象和结论 。
解析:此题设涉及的反应有:Cu(NO3)2+Fe==Cu+Fe(NO3)2和Fe+2HCl==FeCl2+H2↑。
答案:固体可能是铜、铁混合物,也可能是铜 取少量固体于试管中,然后加入足量稀盐酸(没有答出足量不得分)。有气泡冒出并有固体剩余,则为铜、铁混合物;无气泡冒出,则为铜。
17.(2008年晋江市)兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
(1)将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
(2)为了比较金属R与铁的活动性强弱,兴趣小组设计下列方案进行实验,请完成下表:
|
你的一种猜想 |
验证方法 |
现象 |
结论 |
|
金属R的活动性比铁 |
将金属R投入
溶液中 |
金属R表面有黑色的物质析出 |
猜想 (选填“正确”或“错误”) |
(3)请根据上述的信息,标出金属Fe、R、Cu在下列金属活动性顺序表中的相应位置。

解析:开放性的考查学生对金属活动性顺序的考查。
答案:(1)前面 (2)强(或弱); FeSO4(或FeCl2等); 正确(或错误) (3) R Fe Cu (顺序中有一个颠倒不得分)
16.(2008年肇庆市)月球的沙土中含有丰富钛铁矿,主要成分为TiO2、Fe2O3等,若用CO还原这种矿石,其中生成铁的化学方程式为: ;用稀盐酸清洗铁钉表面的铁锈(主要成分是Fe2O3),其化学方程式为: ,该反应属于 反应(填化学反应的基本类型)
解析:掌握炼铁的原理,酸与金属氧化物的反应和用途
答案:3CO+Fe2O3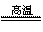 2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O
复分解
2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O
复分解
15.(2008年咸宁市)有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,回答下列问题:
(1)X、Y和Z的金属活动性由强到弱的顺序为 ;
(2)举出符合上述金属活动性顺序的三种常见金属(写化学式) ;并写出在Z表面有银析出反应的化学方程式 。
解析:由化学反应的现象可推知金属的活动性顺序为由强到弱的顺序为XYZ,根据金属活动性顺序可选择符合的金属对号入座。
.答案:(1) X Z Y (2)Fe Cu Pt(其它合理答案也可) Cu + 2gNO3==Cu(NO3)2 + 2Ag
14. Cu(或铜)Fe(或铁)
解析:根据金属活动性顺序,加入的铁粉只能置换铜而不能置换铁来,所以加入过量的铁粉后,所得固体除了铜,还有反应后剩余的铁粉。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com