
题目列表(包括答案和解析)
3.(2010·模拟题)在下列四种演示金属钾与水反应的实验装置图中正确的是( )

解析:钾与H2O反应非常剧烈,能使产生的H2燃烧并发生轻微的爆炸,为防止液体溅出,需在反应器口部盖上玻璃片。
答案:B
2.(2010·改编题)下列物质的保存方法正确的是( )
①少量金属钠保存在汽油中 ②浓硝酸盛放在棕色带橡胶塞的试剂瓶中 ③少量金属钾保存在煤油中 ④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中 ⑤氯水盛放在带有玻璃塞的无色细口瓶中
⑥碳酸钠固体保存在带有橡胶塞的细口瓶中
A.②③④ B.③④⑥ C.③④ D.①③④
解析:金属钠保存在煤油中,浓硝酸和氯水盛放在棕色试剂瓶中,碳酸钠固体保存在带有橡胶塞的广口瓶中。
答案:C
1.(2010·模拟题)碱金属元素是周期性表现得最鲜明和最规律的一族元素。下列说法正确的是( )
A.碱金属单质中锂的密度最小,熔点最低
B.碳酸钾溶液的pH<7
C.乙醇与金属钾反应生成氢气
D.用电解铯盐溶液的方法冶炼金属铯
解析:锂的熔点高于100℃,而其它碱金属单质的熔点均低于100℃,且从Li→Cs熔点依次降低,A项不正确;常温下,K2CO3(aq)的pH>7,B项不正确;铯是很活泼的金属元素,电解含Cs+的盐溶液时,阴极上不会析出Cs,D项不正确。
答案:C
15.(2010·模拟题)国家环保总局“2006年环境监测公报”指出,减少SO2的排放和生活
废水的处理是我国“十一五”期间环境保护的主要任务。请回答下列问题:
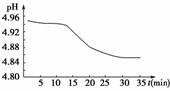
(1)SO2的排放是造成酸雨的主要因素。某地区酸雨pH随时间的变化如图所示。请用
化学方程式表示该地区酸雨pH随时间增加而减小的原因
_______________________________________________________________________。
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用
一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产
品。该技术的优点是
_______________________________________________________________________。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫
的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO===2CO2+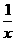 Sx、C
Sx、C
O+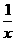 Sx===COS、2COS+SO2===2CO2+
Sx===COS、2COS+SO2===2CO2+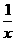 Sx。其中COS分子的空间构型为 。
Sx。其中COS分子的空间构型为 。
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。
请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式
为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺
进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:
NH4++2O2===NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请
写出加入甲醇后反应的离子方程式
_____________________________________________________________________。
解析:根据SO2的性质可知,SO2与H2O形成H2SO3,H2SO3是弱酸且具有较强的还
原性,能被空气中的O2氧化为酸性很强的H2SO4,从而导致溶液的pH减小,当溶
液中的H2SO3全部转化为H2SO4时,溶液的pH保持不变。
(2)根据新型氨法烟气脱硫技术反应原理:SO2+2NH3·H2O===(NH4)2SO3+H2O,SO2
+NH3·H2O===NH4HSO3,因H3PO4的酸性比H2SO3强,故H3PO4能与NH4HSO3和
(NH4)2SO3发生反应释放出SO2,将生成的SO2进行回收再利用。NH4HSO3+
H3PO4===NH4H2PO4+SO2↑+H2O,(NH4)2SO3+H3PO4===(NH4)2HPO4+SO2↑+
H2O。向含有NH4H2PO4和(NH4)2HPO4的混合液中通入NH3后全部转化为(NH4)3PO4:
2NH3+NH4H2PO4===(NH4)3PO4,NH3+(NH4)2HPO4===(NH4)3PO4,(NH4)3PO4中含
有N、P两种元素属于复合肥。
(3)因O、S属于同一主族,COS的结构与CO2相似,为直线形分子。
(4)悬浮沉降一般加入能产生胶体的吸附剂来实现,如KAl(SO4)2·12H2O、FeCl3、
FeSO4·7H2O等。CH3OH在酸性环境下被HNO3氧化为CO2,同时NO3-被还原为N2,
再根据得失电子守恒和原子守恒即可写出其反应的离子方程式。
答案:(1)2H2SO3+O2===2H2SO4
(2)既能回收利用SO2,又能得到复合肥磷铵
(3)直线形
(4)KAl(SO4)2·12H2O或FeSO4·7H2O
6NO3-+5CH3OH+6H+===3N2↑+5CO2↑+13H2O
14.(2010·烟台市开发区一中期中考题)在下图所示转化关系中,已知:①B、F均是淡黄
色固体;②I、D为气态单质,A、B为固态单质;③F、G、H的相对分子质量分别
比C、D、E的相对分子质量大16。
(1)写出下列物质的化学式:
A________,B________,D________,K________。
(2)写出下列物质的电子式:F________,G________。
(3)写出下列转变的化学方程式:
C+I―→F
___________________________________________________________________,
F+E
_______________________________________________________________________。
解析:由B、F为淡黄色固体入手,B为S,F为Na2O2,F、G、H的相对分子质量
分别比C、D、E的相对分子质量大16,则I单质为O2,其余物质可推知如下图所示。
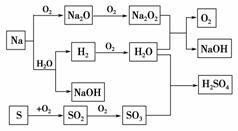
答案:(1)Na S H2 H2SO4 (2)Na+[··············]2-Na+ H········H
(3)2Na2O+O22Na2O2 Na2O2+SO2===Na2SO4
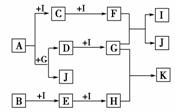
13.(2010·模拟题)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化
关系:
ABC
(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”。则X的化学式为
_______________________________________________________________________。
(2)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖
红色沉淀生成;C能使湿润的蓝色石蕊试纸变红。则A与C在浓硫酸和加热条件下
反应的化学方程式为
_______________________________________________________________________。
(3)若A、B、C的焰色反应均为黄色,A是一种工业原料,B俗称小苏打,电解C的
水溶液可以得到两种气态产物,这两种气态产物在工业上可以合成X,则电解C的
水溶液的离子方程式为
_______________________________________________________________________。
(4)若A、C为无色溶液。B为白色胶状沉淀,是治疗胃酸过多的一种药物的主要成分,
X的焰色反应为黄色,则C溶液中除氢氧根外还存在的阴离子的化学式为
_______________________________________________________________________。
(5)若A、B、C均为氧化物,X是一种黑色固态非金属单质,则B分子的结构式为
________________。
解析:(1)B是造成酸雨的“罪魁祸首”可以判断,结合A是一种淡黄色固体,可以
推知A、B、C、X分别是S、SO2、SO3、O2。
(2)由题给信息可知,A、B、C分别是CH3CH2OH、CH3CHO、CH3COOH,所以A
与C反应的方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
(3)焰色反应为黄色,说明A、B、C中均含钠元素,B俗称小苏打,故B是NaHCO3,
C是NaCl,A是碳酸钠,X为HCl,则电解NaCl溶液的离子方程式为:2Cl-+
2H2OH2↑+Cl2↑+2OH-。
(4)由B的状态及用途可知B是Al(OH)3,结合X的焰色反应为黄色,可推知A、C、
X分别为AlCl3、NaAlO2或Na[Al(OH)4]和NaOH。
(5)“X是一种黑色固态非金属单质”,所以是炭。A、B、C分别是CuO或Fe2O3、
二氧化碳和一氧化碳。
 答案:(1)O2 (2)CH3COOH+C2H5OH CH3COOC2H5+H2O
答案:(1)O2 (2)CH3COOH+C2H5OH CH3COOC2H5+H2O

 (3)2Cl-+2H2OH2↑+Cl2↑+2OH- (4)AlO2-或[Al(OH)4]- (5)C O O
(3)2Cl-+2H2OH2↑+Cl2↑+2OH- (4)AlO2-或[Al(OH)4]- (5)C O O
12.(2010·绍兴一中期中考题)“活动与探究”是新课标中探究性学习的方式之一。下面
是某学习小组对硫及其化合物的性质探究。请你回答其中的问题。
(1)硫溶解性探究:①取绿豆粒大小的硫,轻轻地放入一支试管(该试管编号为1)中,
然后在试管1中加入4 mL无水乙醇,振荡,静置一段时间;②将试管1内的上层“乙
醇”倾倒到另外一支试管(编号为2)中约一半(2 mL左右),然后在试管2中加入2 mL
蒸馏水,注意与试管1内的“乙醇”比较。可以观察到试管2内的溶液中有浑浊产生。
该浑浊的成分是________,出现这种现象的原因是:
_______________________________________________________________________。
(2)硫氧化性探究:①取一药匙还原性铁粉和一药匙硫粉,放在石棉网上,用药匙搅
拌,使铁粉与硫粉混合均匀;将石棉网放在三脚架上,用酒精灯火焰加热铺有铁硫混
合物的石棉网,可以观察到石棉网上的铁硫混合物逐渐红热,红热位置逐渐蔓延,最]
后生成黑色的物质;②取该黑色物质,放入试管中,然后在试管中滴入1 mL稀盐酸,
可以观察到试管内有气泡产生,且闻到一股强烈的臭鸡蛋气味;③在上述反应后的溶
液中滴加KSCN溶液,溶液为无色,由此推测①中的黑色物质是________。
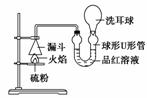
(3)SO2的漂白性探究;在如图所示的石棉网上堆放少许硫粉,点燃,可以观察到硫
燃烧,然后用洗耳球抽取球形U形管中的气体,可以观察到球形U形管内的品红溶
液 ,微热U形管,溶液变为 。
(4)SO2氧化性实验探究:按照(3)中装置,重新换一支球形U形管,在其中加入少许
FeS,滴加几滴稀盐酸,在石棉网上硫燃烧的同时,捏瘪洗耳球,吸取球形U形管中
的气体,可以观察到球形U形管左侧管内壁有黄色物质附着。则生成该黄色物质的
化学方程式是:
_______________________________________________________________________。
解析:(1)硫微溶于乙醇,难溶于水,向硫的乙醇饱和溶液中加入水,由于水与乙醇
互溶,“消耗”了部分乙醇,故硫析出而出现浑浊。
(2)从加入KSCN溶液后,溶液为无色可以推断溶液中无Fe3+,故硫与铁发生氧化还
原反应生成的是FeS,而不是Fe2S3。
(3)二氧化硫可以使品红溶液褪色,生成的是不稳定的无色物质,受热后分解,二氧
 化硫释放出来,品红溶液又变为红色。
化硫释放出来,品红溶液又变为红色。
(4)硫燃烧产生二氧化硫:S+O2 SO2;FeS与盐酸反应产生硫化氢:
FeS+2HCl===H2S↑+FeCl2;二氧化硫与硫化氢发生氧化还原反应生成硫:2H2S+
SO2===3S↓+2H2O。
答案:(1)硫(或“S”) 硫在水中不溶解,在乙醇中微溶,在溶有硫的乙醇中加入水,
部分硫析出,形成浑浊 (2)FeS (3)褪色 红色 (4)2H2S+SO2===3S↓+2H2O
11.(2010·模拟题)硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化
硫和氧气。请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的
硫酸铜的物质的量的关系。实验测得数据和有关结果如下:
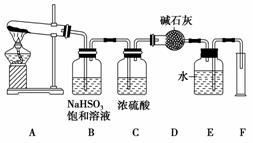
①准确称得无水硫酸铜2.4 g;
②测出量筒中水的体积,折算成标准状态下气体的体积为112 mL;
③干燥管在实验后质量增加1.28 g;
④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质)。
试回答:
(1)装置B的作用是________________,发生的化学方程式
_______________________________________________________________________。
(2)装置C的作用是________________,干燥管收集到的物质是________。
(3)装置E和F的作用是
_______________________________________________________________________。
(4)实验数据测出后,首先应计算出的物质是________,有________mol。据此计算出
SO2为________mol,SO3为________mol。
(5)CuSO4分解反应方程式为
_______________________________________________________________________。
解析:实验目的是测定n(CuSO4)与n(CuO)、n(SO2)、n(SO3)、n(O2)之间的关系;实
验原理是3CuSO43CuO+2SO2↑+SO3↑+O2↑,利用A作发生装置,B是将
SO3转化成SO2,发生反应SO3+2HSO3-===SO42-+2SO2↑+H2O;C是吸收混合气
体中的H2O(g);D是吸收混合气体中的SO2;E和F确定n(O2)。结合题干已知条件
可以求得:n(CuSO4)=0.015 mol、n(SO2总)0.02 mol、n(O2)=0.005 mol。根据CuSO4
分解反应中电子转移守恒可知0.015 mol CuSO4分解得到的SO2为0.01 mol,同时得
到SO3为0.005 mol。
答案:(1)吸收生成的SO3气体 SO3+2NaHSO3===Na2SO4+H2O+2SO2↑
(2)干燥 SO2和O2
(3)由D来的气体将E中的水压到量筒F中,测定生成O2的体积
(4)O2 0.005 0.01 0.005
(5)3CuSO43CuO+2SO2+O2↑+SO3
10.(2010·改编题)科学家在多年前就探测到火星大气中存在微量的羰基硫(COS)。已知
能发生下列反应:CO+SCOS,2COS+SO22CO2+3S。(已知CO的结构式
为C,O,有两个共价键和一个配位键)下列说法不正确的是( )
A.CO、CO2分子中每个原子最外层都达到了8电子稳定结构
B.原子半径:S>C>O
C.CH3COSH和CH3CSOH是同一种物质
D.SO2气体中混有的少量SO3可通过盛有饱和NaHSO3(aq)或浓H2SO4的洗气瓶除去
解析:选项C中CH3COSH是CH3COOH分子中羟基中的O被S取代的产物,而
CH3CSOH是CH3COOH分子中羰基中的O被S取代的产物,很显然两者是不同的物
质,属于同分异构体。
答案:C
9.(2010·模拟题)如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触
纸条为准)。则下列有关说法正确的是( )
A.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
B.沾有KMnO4溶液的滤纸、湿润的品红试纸均褪色证明了SO2有漂白性
C.湿润的蓝色石蕊试纸先变红后褪色
D.NaOH溶液可用于除去实验中多余的SO2
解析:A项,SO2不能氧化I-,说明SO2的氧化性比I2的弱,A项正确;B项,SO2
使KMnO4(aq)褪色,表现出了SO2的还原性,B项不正确;C项,SO2只能使石蕊变
红,但不能使其褪色,C项不正确;D项,NaOH可吸收SO2,正确。
答案:AD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com