
题目列表(包括答案和解析)
0.1 mol/L,pH=1。要使溶液恢复原状,应加入CuO 0.025 mol,即2 g。
(4)因为可溶性盐,电解时得O2,酸根只有常见的SO42-和NO3-,应从这两个角度去
鉴定。
答案:(1)4OH--4e-===2H2O+O2↑ (2)2Cu2++2H2O2Cu+O2↑+4H+
(3)1 CuO 2 (4)①假设原溶液中的酸根离子是SO42-。取电解后的溶液,向其中
加入BaCl2溶液,若有白色沉淀生成,则原溶液中所含的酸根离子是SO42-
②假设原溶液中的酸根离子是NO3-。取电解后的溶液,向其中加入铜,微热,若铜
溶解,并有无色气体生成,且在空气中变为红棕色,则原溶液中所含的阴离子是NO3-
12.在如图用石墨作电极的电解池中,放入500 mL含一种溶质
的某蓝色溶液进行电解,观察到A电极表面有红色的固态物
质生成,B电极有无色气体生成;当溶液中的原有溶质完全
电解后,停止电解,取出A电极、洗涤、干燥、称量,电极
增重1.6 g。请回答下列问题:
(1)B电极发生反应的电极反应式_________________________。
(2)写出电解时反应的离子方程式_________________________________________。
(3)电解后溶液的pH为________,要使电解后溶液恢复到电解前的状态,则需加入
________,其质量为________g。(假设电解前后溶液的体积不变)
(4)请你设计实验确定原溶液中可能含有的酸根离子,要求:提出两种可能的假设,
分别写出论证这两种假设的操作步骤,实验现象和实验结论。
①假设一:____________________________________________________________;
②假设二:____________________________________________________________。
解析:(1)蓝色溶液含Cu2+,A电极有红色固体物质生成,则析出Cu,为阴极;
B电极为阳极,析出O2,电极反应式为:4OH--4e-===2H2O+O2↑。
(2)2Cu2++2H2O2Cu+O2↑+4H+
(3)当溶液中溶质完全电解时,得n(Cu)==0.025 mol。此时溶液中c(H+)=
11.工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中
加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3
沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题。
(1)两极发生的电极反应式
(2)写出Cr2O72-变为Cr3+的离子方程式______________________________________。
(3)工业废水由酸性变为碱性的原因是_______________________________________。
(4)________(填“能”或“不能”)改用石墨电极,原因是______________________。
解析:本题除铬的思路:Cr2O72-Cr3+Cr(OH)3↓。电解时阳极被氧化而
生成Fe2+,Fe2+显然是还原剂,将Cr2O72-还原为Cr3+,本身被氧化为Fe3+;反应式
为:Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。该反应消耗了溶液中的H+,
另外阴极H+放电生成氢气,又会使溶液中的OH-浓度增大。完成了工业废水从弱酸
性到碱性的转变,进而发生了如下的离子反应:Cr3++3OH-===Cr(OH)3↓(铬被除
去),Fe3++3OH-===Fe(OH)3↓。
答案:(1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
(3)H+不断放电,Cr2O72-与Fe2+反应时消耗H+,打破了水的电离平衡,使溶液中
c(OH-)>c(H+)
 Cr3+→Cr3+→Cr(OH)3↓而除去铬
Cr3+→Cr3+→Cr(OH)3↓而除去铬
10.下列关于铜电极的叙述,不正确的是 ( )
A.电池反应为2Ag++Cu===2Ag+Cu2+的原电池中,铜作负极
B.电解法精炼粗铜时,精铜作阴极
C.电解饱和食盐水制H2、Cl2、NaOH时,铜作阳极
D.在镀件上镀铜时,铜作阳极
解析:铜和银离子组成的原电池中,铜作负极,被氧化,A正确;电解精炼铜时,
粗铜作阳极,精铜作阴极,B正确;电解饱和食盐水时用铜作阳极,铜会被氧化生
不成Cl2;电镀铜时,铜作阳极,镀件作阴极,D正确。
答案:C
9.按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量,下列叙
述正确的是 ( )

A.F表示反应生成Cu的物质的量 B.E表示反应实际消耗H2O的物质的量
C.E表示反应生成O2的物质的量 D.F表示反应生成H2SO4的物质的量
解析:电解实质为2CuSO4+2H2O2Cu+O2↑+2H2SO4,则每通过4 mol e-,
生成Cu 2 mol,O2 1 mol,耗H2O 2 mol,生成H2SO4 2 mol。
答案:B
8.(2010·南京期末)用惰性电极电解2 L 1.0 mol/L CuSO4溶液,在电路中通过0.5 mol
电子后,调换正负极继续电解,电路中通过了1 mol电子,此时溶液中c(H+)为(假设
体积不变) ( )
A.1.5 mol/L B.0.75 mol/L C.0.5 mol/L D.0.25 mol/L
解析:调换正负极前后电极反应式如下:
前
后
故电路中转移的1.5 mol电子中,只有1 mol由OH-放电产生,即消耗的n(OH-)=
1 mol,即溶液中积累的n(H+)=1 mol,则c(H+)=0.5 mol/L。
答案:C
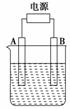
7.(2008·全国理综Ⅱ)右图为直流电源电解稀Na2SO4水溶液的装置,
 通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实
通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实
验现象中正确的是 ( )
A.逸出气体的体积:a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
解析:电解Na2SO4溶液其实质是电解水,a与电源负极相连为电解池的阴极,H2O
电离产生的H+在该极获得电子产生H2,同时生成OH-:2H2O+2e-===H2↑+2OH-,
产生的OH-与石蕊作用呈蓝色。b与电源正极相连为电解池的阳极,H2O电离产生
的OH-在该极失去电子产生O2,同时生成H+:H2O-2e-===O2↑+2H+,产生的
H+与石蕊作用呈红色。
答案:D
6.某学生欲完成反应2HCl+2Ag===2AgCl↓+H2↑而设计了下列四个实验,你认为可
行的是 ( )
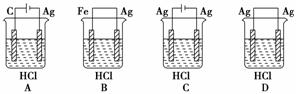
解析:题给反应是一个不能自发进行的氧化还原反应,必须借助电解手段才能使之发
生。B、D两装置不是电解池,显然不能使之发生;A装置是电解池,但Ag棒作阴极
而不参与反应,其电解池反应不是题给反应,A装置不能使题给反应发生;C装置是
电解池,Ag棒作阳极而参与反应,其电解池反应是题给的反应,C装置能使题给的
反应发生。
答案:C
5.个别电解水设备推销商进行下列电解水实验:将纯净水与自来水进行对比,当电解器
插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水中却
冒出气泡并生成红褐色或灰绿色的絮状物。推销商趁此解释说自来水中含有对人体有
毒有害的物质,长期饮用对身体有害。有关专家解释说,推销商用科学知识诱骗消费
者,推销商做实验时用铁棒和铝棒作电极。下列判断错误的是 ( )
A.推销商做实验时,用铁棒作阳极
B.电解纯净水和自来水时的现象不同是因为纯净水和自来水所含电解质溶液浓度不
同
C.铝棒电极发生的电极反应为Al-3e-===Al3+
D.电解自来水时出现“红褐色或灰绿色的絮状物”是因为产生了铁的氢氧化物
解析:自来水与纯净水的差异在于自来水导电性强,电解现象明显;铁棒连接电源的
正极,Fe失去2个电子成为亚铁离子,发生氧化反应,而铝棒连接电源负极,铝不参
加反应,该电极发生的反应为:2H2O+2e-===H2↑+2OH-,产物为氢气和氢氧根离
子,氢氧根离子与阳极产生的亚铁离子形成Fe(OH)2沉淀,该沉淀不稳定,易被氧气
氧化为红褐色的Fe(OH)3沉淀。
答案:C
4.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接
线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说
法中正确的是( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
解析:对于蓄电池,充电和放电过程中发生的电极反应相反。铅蓄电池标有“+”的
接线柱,表示原电池的正极,放电时该极发生还原反应,当充电时,该极发生氧化反
应,因此标有“+”的接线柱,充电时作阳极。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com