
题目列表(包括答案和解析)
2.(2009·天津)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
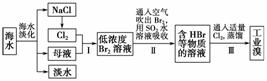
(1)请列举海水淡化的两种方法________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为________________________________________________________________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________________________________________________________。
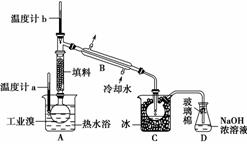 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图;
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图;
请你参与分析讨论:
①图中仪器B的名称:________________________________________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:______。
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_______________________________。
解析:(2)电解NaCl溶液的产物有H2、Cl2、NaOH,若发生反应Cl2+2NaOH===NaCl+NaClO+H2O,则产物为H2和NaClO。
(5)提纯溴的实验中,要注意Br2的沸点高低,溴的沸点低于100℃,应采用水浴加热,并通过温度计控制温度。除去Br2(液)中少量Cl2,加NaBr溶液后,Br2在水中溶解度不大,出现分层现象,可分液得到纯溴,亦可采用再次蒸馏的方法。
答案:(1)蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种 (2)Cl2 NaOH NaClO
(3)富集溴元素 (4)Br2+SO2+2H2O===4H++SO42-+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分 ④深红棕色 分液(或蒸馏)
考点3 常见气体的制备
1.(2009·浙江)下列说法正确的是( )
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
解析:A项加硝酸酸化的硝酸银,亚硝酸钠无沉淀,氯化钠有白色沉淀。亚硝酸钠溶于水后显碱性,若不加硝酸,会产生AgOH等白色沉淀干扰。C项乙酸与乙醇互溶,不分层,不能用分液漏斗分离。D项酸式滴定管未用标准液润洗,则标准液会被稀释,浓度降低,所用体积增大,使测定结果偏高。
答案:B
考点2 物质的制取、分离和提纯
13.已知:以铜作催化剂,用空气氧化醇制取醛,事实上是空气先与铜反应生成氧化铜,热的氧化铜再氧化醇生成醛。某实验室中用甲醇、水、空气和铜粉(或氧化铜)制取甲醛溶液。下表给出甲醇、甲醛的沸点和水溶性:
|
|
沸点/℃ |
水溶性 |
|
甲 醇 |
65 |
与水混溶 |
|
甲 醛 |
-21 |
与水混溶 |
 下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如图甲、乙所示:
下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如图甲、乙所示:
请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是________________。
(2)若按甲装置进行实验,则通入A中的X是________,B中发生反应的化学方程式为__________________。
(3)若按乙装置进行实验,则B中应装入的物质是________。
(4)C中应装入的试剂是________。
(5)两套装置中都需要加热的仪器有________(填“A”、“B”或“C”)。
(6)若欲得到较浓的甲醛溶液,你认为选用哪套装置较好,________(填“甲”或“乙”)。
(7)验证实验后C中含有甲醛,所用试剂是________。
解析:对比甲、乙两装置,可知通入A中的X为空气,可以通过持续加入来提供O2,所以B中加入的铜粉主要起催化作用。而乙中无法补充空气(提供O2),因此应在B中加入较多的CuO与甲醇反应。
答案:(1)检查装置的气密性 (2)空气 2CH3OH+O2Cu△2HCOH+2H2O (3)CuO (4)H2O (5)AB (6)甲 (7)新制Cu(OH)2悬浊液(或银氨溶液)
12.(2010·睢宁)从有机反应R-H+Cl2R-Cl(液)+HCl(气)制取副产品盐酸的设想已成为现实。请根据所给模拟装置图回答下列问题:
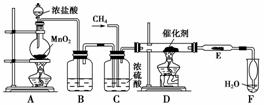
(1)装置B中盛放的溶液和作用分别是________,________。
(2)写出C装置的三种功能:①________;②________;③________。
(3)玻璃管E中所放石棉碎块和碘化钾混合物的作用分别是:①石棉碎块________,②碘化钾________。
(4)导管末端“起肚”形的作用是________。从F中分离出盐酸的最佳方法是________。
(5)①点燃A处酒精灯,②点燃D处酒精灯,③通入CH4,这三种操作的先后顺序是________(依次填代号)。
解析:从整个实验思路上分析上述实验装置,很明显地分成三个部分,第一部分为Cl2的制取和净化,包括装置A、B、C;第二部分为有机反应的发生装置D;第三部分为后期处理装置E、F。
答案:(1)饱和食盐水 除去Cl2中混有的HCl
(2)①干燥Cl2、CH4 ②使CH4、Cl2充分混合 ③观察气泡的产生情况,便于控制两种气体的配比
(3)①做KI的填充物,以保证Cl2与KI充分接触反应 ②除去未反应完的Cl2
(4)防止倒吸 分液 (5)③①②
11.氢氧化铜是一种常用试剂。如:利用氢氧化铜验证葡萄糖的还原性。
下面是三个研究性学习小组分别从不同层面开展的探究性学习活动:
(1)研究性学习小组甲:对“葡萄糖与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑:他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,进行了如下探究:
提出猜想:_________________________________________________________。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硝酸中,观察是否有残渣
方案3:称取该红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次,直到固体恒重,称得质量为b g,比较a、b的关系
方案4:取该红色沉淀放入试管里,加入酸化的硝酸银溶液,观察是否有白色的银析出
你认为合理的方案是____________________________________________________。
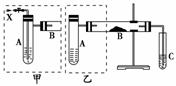
(2)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述沉淀成分必须测定下列哪些物理量:_______________________。
①通入氢气体积 ②反应前,红色沉淀和硬质试管的总质量 ③完全反应后,红色固体和硬质试管的总质量 ④实验前,干燥管质量 ⑤硬质试管质量 ⑥锌粒质量 ⑦稀硫酸中含溶质的量 ⑧实验后,干燥管质量
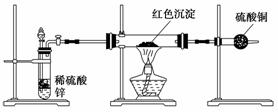
(3)研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的化学家”,绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求,他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案_________________________________________
________________________________________________________________________。
解析:(1)由于Cu也是红色的,因此可猜想红色沉淀中含Cu。根据其资料可知Cu+可发生自身氧化还原反应,因此方案1、2中足量的稀HNO3均把Cu与Cu+氧化,无法保证Cu的检验,方案4中在酸性条件下Cu+可生成Cu然后置换出Ag,仍无法验证Cu的存在,故方案3通过质量的增重能够判断Cu的存在。
(2)小组乙通过H2还原Cu2O,由固体质量的变化确定Cu2O的含量,由于干燥管中硫酸铜有可能吸收空气中的水蒸气不能作为计算依据,H2的总量比实际消耗大的多也不能作为计算依据,因此必须测定②、③、⑤数据。
(3)保证环保不能使用浓H2SO4,采用先氧化后酸化的步骤。
答案:(1)红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜) 方案3
(2)②③⑤
(3)在空气中充分灼烧红色固体变成黑色固体后,将黑色固体完全溶于适量稀硫酸中,将溶液蒸发、结晶,即得蓝矾
10.(2009·山东邹城)北京2008年奥运会金牌直径为70 mm,厚6 mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制成;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成。为了验证他们的猜想,请选择一种试剂来证明甲、乙、丙猜想的正误( )
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
解析:Cu和Zn完全溶于稀硝酸,Ag也能溶于稀硝酸,但Au不溶。如果金牌全部溶解,那是由黄铜制成的;如果金牌部分溶解(或质量变轻,有不溶解的部分),那是由金银合金制成的;如果金牌完全不溶解,也没有气体产生,那是由纯金制成的。
答案:C
9.实验室里需要配制480 mL 0.1 mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是( )
|
选项 |
容量瓶容积 |
溶质质量 |
实验操作 |
|
A |
480 mL |
硫酸铜:7.68
g |
加入500 mL水 |
|
B |
480 mL |
胆矾:12.0 g |
配成500 mL溶液 |
|
C |
500 mL |
硫酸铜:8.0 g |
加入500 mL水 |
|
D |
500 mL |
胆矾:12.5
g |
配成500 mL溶液 |
解析:因为没有480 mL的容量瓶,只能配制500 mL溶液;计算时注意,需8 g CuSO4或12.5 g CuSO4·5H2O。
答案:D
8.(2009·洛阳)科学的假设与猜想是科学探究的先导和价值所在。在下列假设引导下的实验探究肯定没有意义的选项是( )
A.探究SO2与Na2O2反应可能有Na2SO4生成
B.探究Na与水反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是CuO
D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,溶液的红色褪去是溶液的酸、碱性改变所致,还是HClO的漂白性所致
解析:金属钠具有强还原性,而要实现H2O向O2的转化,必须加氧化剂,故B项没有探究意义。
答案:B
7.某研究性学习小组为了探索镁粉与FeCl3溶液反应的机理,做了如下两组实验:
(1)将镁粉投入冷水中,未见明显现象;(2)将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀。则下列叙述中正确的是( )
A.镁只与FeCl3溶液中的Fe3+直接反应
B.气泡是镁与FeCl3溶液中的水直接反应产生的
C.红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得
D.气泡是镁与FeCl3水解生成的盐酸反应产生的
解析:在溶液中存在FeCl3的水解,其水解方程式为:FeCl3+3H2O Fe(OH)3+3HCl,Mg与水解产生的盐酸反应生成H2,并使平衡向正反应方向移动,生成Fe(OH)3沉淀。
Fe(OH)3+3HCl,Mg与水解产生的盐酸反应生成H2,并使平衡向正反应方向移动,生成Fe(OH)3沉淀。
答案:D
6.欲证明一瓶无色液体是纯水,可靠的实验方法是( )
A.测得其pH=7
B.跟钠反应生成氢气
C.电解时得到氢气和氧气,且两者在相同状态下的体积比为2∶1
D.在1.013×105 Pa时其沸点为100℃
解析:A项未确定温度,pH=7时不一定是中性,即使是中性也不一定是纯水;B项中能与钠反应生成氢气的不一定是水,也可能是其它溶液;C项,电解时产生H2与O2之比为2∶1,可能是H2SO4或Na2SO4等水溶液。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com