
题目列表(包括答案和解析)
8.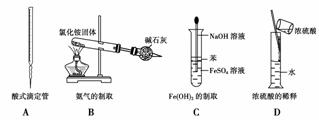 (2009·华南师大附中综合模拟三)如图所示对实验仪器名称的标注或实验操作正确的是( )
(2009·华南师大附中综合模拟三)如图所示对实验仪器名称的标注或实验操作正确的是( )
解析:A中滴定管是碱式滴定管,A项错误;B中NH4Cl受热分解产生的NH3与HCl在冷却后会重新反应生成NH4Cl,得不到NH3,B项错误;D中量筒不能作配制溶液的仪器,且浓硫酸稀释时放出大量的热量,不能在量筒中进行,D项错误;C中避免了二价铁的氧化,C项正确。
答案:C
7.(2009·浙江武义)下列关于实验室一般事故的预防和处理方法正确的是( )
A.燃着的酒精灯打翻失火,应立即用水浇灭
B.少量酸或碱滴到实验台上,立即用湿抹布擦净,再用水冲洗
C.金属钠着火时,可用干粉灭火器扑灭
D.蒸发食盐溶液时,发生液滴飞溅,应立即加水冷却
解析:A项应用沙子扑灭;C项钠着火生成Na2O2,Na2O2与CO2反应生成O2,加速钠燃烧;D项水加到热的蒸发皿中,易造成液体飞溅和仪器炸裂等。
答案:B
6.(2010·淄博)用下列方法清洗所用仪器:①用盐酸清洗长期盛过硬水的试剂瓶;②用二硫化碳清洗沾有硫磺的试管;③用酒精清洗沾有苯酚的试管;④用热NaOH溶液清洗盛过油脂的烧杯;⑤用稀硝酸清洗做过银镜反应的试管;⑥用氢氟酸清洗做过硅酸分解实验的瓷坩埚。则下列说法正确的是( )
A.除①②外都正确 B.除③外都正确
C.除⑥外都正确 D.全都正确
解析:①长期存放硬水的试剂瓶瓶壁上有CaCO3、Mg(OH)2等沉淀,可用盐酸清洗;②硫磺易溶于CS2;③苯酚易溶于酒精;④油脂在碱性条件下,水解生成可溶的高级脂肪酸钠和甘油,从而除去油脂;⑤银可溶于稀硝酸,且稀硝酸用量少,产生NO气体少;⑥HF可与SiO2反应,不能用氢氟酸清洗瓷坩埚。
答案:C
5.(2009·山师附中模拟二)在化学实验中必须注意安全操作,下列实验操作或事故处理正确的是( )
①在点燃易燃性气体前,必须检验气体的纯度 ②在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 ③浓硫酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸溶液 ④给试管中的液体加热时,液体体积不超过试管容器的1/3 ⑤点燃添满酒精的酒精灯
⑥金属钠着火时可用干粉灭火器扑灭
A.仅①② B.仅①②③ C.仅①②④ D.全部
解析:浓硫酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用抹布拭去,再用较多的水冲洗,最后涂上3%-5%的NaHCO3溶液;点燃添满酒精的酒精灯,由于酒精具有挥发性,很可能发生爆炸;干粉灭火器的主要成分是NaHCO3,在受热的条件下,NaHCO3会产生Na2CO3和CO2,而Na燃烧生成的Na2O2会与CO2反应生成助燃气体O2,因此不能用干粉灭火器扑灭,应用干沙灭火。
答案:C
4.下列实验基本操作错误的是( )
A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
D.玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上
解析:A项是中和滴定实验的基本操作,滴定管必须用所盛装的液体润洗后才能进行实验;B项是有关仪器的连接知识的考查,玻璃管和橡皮管的连接是仪器连接中最基本的连接;C项是中学化学中的重要定量实验之一--硫酸铜晶体结晶水含量的测定,加热后必须放在干燥器中冷却,防止吸收空气中的水蒸气而影响测定的准确性;D项中有关pH试纸的使用也是要求考生掌握的一项基本操作。
答案:A
3.(2009·广东模拟)下列试剂应保存在棕色试剂瓶中的是( )
A.乙醇 B.浓硝酸 C.福尔马林 D.氨水
解析:浓硝酸在光照或受热时会发生分解:4HNO3(浓)4NO2↑+O2↑+2H2O,因此浓硝酸应用棕色试剂瓶进行避光保存;氨水见光不易分解。
答案:B
2.(2008·宁夏理综卷)图标所警示的是( )
A.当心火灾--氧化物 B.当心火灾--易燃物质
C.当心爆炸--自燃物质 D.当心爆炸--爆炸性物质
解析:该题主要考查对实验安全警示图标的记忆,该图标是易燃物标识,易燃物则易引起火灾,故选B。
答案:B
1.下列操作中完全正确的一组是( )
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部 ②给盛有液
体体积超过1/3容积的试管加热 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平
放,用纸槽往试管里送入固体粉末,然后竖立试管 ⑤取用放在细口瓶中的液体时,
取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面 ⑥将烧瓶放在桌上,用
力塞紧塞子 ⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中 ⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩ B.①④⑤⑦⑩
C.①④⑤⑦⑧⑩ D.④⑤⑦⑧⑩
解析:②给盛有液体的试管加热时,液体量不能超过试管容积的1/3,否则液体易溅出;③闻气体的气味时,不可把鼻孔靠近容器口,应用手在瓶口处轻轻扇动,让少量气体飘进鼻孔;⑤倾倒液体时瓶上的标签应对着手心;⑥向烧瓶口塞塞子时,应用手持烧瓶,慢慢将瓶子塞紧;⑧向试管中滴加液体时,一般不可将滴管伸进试管内,以免对试剂造成污染;⑨不可在量筒中稀释浓硫酸,也不可把水倒入浓硫酸中。
 答案:A
答案:A
10.47%,结合阴、阳离子放电顺序可知,丙中实质是电解水。经过简单计算:
100×10.00%=(100-x)×10.47%,
可知x=4.5 g,
即n(H2O)=0.25 mol,据2H2O2H2↑+O2↑可知0.25 mol水放电转移电子数
为0.5 mol,由此求得③④两问。
另一突破口即是:乙中c电极质量增加。说明c为阴极,析出铜。由此推知各电极
名称及电源M、N的名称。进而判断书写各电极反应式及产物。相关计算:③问:
b极析出O2:×22.4 L/mol=2.8 L。④问:c极析出铜质量为:×
64 g/mol=16 g。
(2)能继续进行若Cu全部析出,溶液为稀硫酸,电解仍然继续进行。
答案:(1)①正 ②4OH--4e-===O2↑+2H2O
③设丙中电解H2O质量为x
100 g×10.00%=(100 g-x)·10.47%
解得x=4.5 g,
n(H2O)==0.25 mol
由关系式2O2↑→O2↑
得b上气体体积为
V(O2)=0.25 mol××22.4 L·mol-1=2.8 L
④16
⑤甲为NaOH溶液,属电解H2O型,故c(NaOH)变大,pH增大 乙为CuSO4溶
液,属“放氧生酸”型,故pH减小 丙是K2SO4溶液,属电解水型,原本是中性,
故pH不变
(2)若Cu全部析出,溶液为稀硫酸,电解仍然继续进行。
5.(2009·全国)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的
NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电
极。
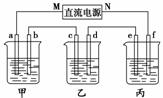
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增
加。据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为_____________________________________________;
③列式计算电极b上生成的气体在标准状况下的体积:_________________________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液________________________________________________________________;
乙溶液________________________________________________________________;
丙溶液________________________________________________________________。
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
______________________________________________________________________
______________________________________________________________________。
解析:本题考查电化学--电解池原理相关知识。图中给出三个串联的电解池,电
解质溶液互不相同,因而电解过程及结果都不同,但它们有一个联系点,就是导线
上通过的电子相等,即电子守恒。这是解该类计算题的基本依据。
本题的突破口之一在于发现丙中K2SO4浓度前后变化情况--浓度由10.00%变为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com