
题目列表(包括答案和解析)
5.室温下,下列叙述正确的是(溶液体积变化忽略不计) ( )
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
|
pH |
11 |
11 |
3 |
3 |
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH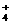 )> c (OH一)> c (H+)
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
4.下列叙 述正确的是 ( )
述正确的是 ( )
①3Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为6:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
A.①② B.②③ C.①③ D.③④
3.下列做法正确的是 ( )
A.用分液漏斗分离乙醇和苯酚的混合物
B.实验室用石灰石和硝酸铵固体混合加热制取氨气
C.中和滴定时滴定管用所盛溶液润洗,锥形瓶不用所盛溶液润洗
D.用37%(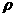 :1.19 g·
:1.19 g· )的浓盐酸配制100 mL 1 mol·
)的浓盐酸配制100 mL 1 mol·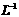 的盐酸溶液,用到的量器为100 mL的量筒和100 mL的容量瓶
的盐酸溶液,用到的量器为100 mL的量筒和100 mL的容量瓶
2.下列离子方程式书写正确的是 ( )
A.向苯酚钠溶液中通入少量CO2;C3H2O-+CO2+H2O→C6H8OH+HCO3-
B.铝片溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C.向1mol碘化亚铁的溶液中通入标准状况下22.4L氯气:
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
1.2009年世界气候大会在丹麦首都举行。控制二氧化碳排放,需要从人人做起,“低碳生活”有望成为新的时尚流行全球。“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放。下列行为不利于低碳生活的是 ( )
A.大排量的轿车代替公交车出行
B.将碳进行气化处理,提高煤的综合利用率
C.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的反复使用(Reuse)、资源的重复再生(Recycle)
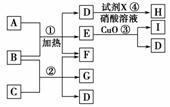
3.现有五种1-20号元素组成A-I纯净物(试剂X、H除外),转化关系如图所示:
相关信息有:
(a)反应④的现象是有白色沉淀生成,且H的相对分子质量为143.5;
(b)在常温下,A、I都是气态单质,且A的水溶液具有漂白性,I的一种同素异形体具有比I更强的氧
化性;
(c)除反应③外,其他反应都在水中进行,1 mol B含28 mol电子;
(d)C是由第三周期的两种元素组成MZ3型化合物。
(1)试剂X的名称为________。
(2)写出反应③的化学方程式:__________________;写出反应①的离子方程式:
________________________________________________________________________。
(3)用离子方程式表示C溶液呈酸性的原因:____________________。
(4)向G的水溶液中通入过量的二氧化碳,写出离子方程式:__________________。
易错分析:因对O3的性质不熟而不能利用“I的一种同素异形体具有比I更强的氧化性”这一条件推
出I为O2,同时易忽视氧化铜作氯酸钾分解反应的催化剂、氯气与KOH在加热条件下反应等盲点知
识,无法正确推断。误认为E为次氯酸钾,导致其他推断错误。
解析:除X、H外,其余物质只含1-20号元素中的五种元素,暗示可能含钾或钙,由信息(a)知,H
为氯化银(M=143.5 g/mol),X为硝酸银溶液,推知D中含有氯离子;由信息(b)知,A为氯气,I为氧
气,联系高一化学“氧化铜作氯酸钾分解反应的催化剂”,E可能是氯酸钾,D可能是氯化钾;B为
强碱,若B为KOH,1 mol KOH含28 mol电子,符合信息(c)。所以,B为KOH,D为KCl,E为KClO3。
再由信息(d)推知,C为氯化铝,G为偏铝酸钾。有关化学反应方程式:反应①3Cl2+6KOH5KCl
+KClO3+3H2O;反应②为AlCl3+4KOH===KAlO2+3KCl+2H2O;反应④为KCl+AgNO3===AgCl↓
+KNO3。因为氢氧化铝不溶于弱酸(碳酸溶液),在偏铝酸钾溶液中通入过量的二氧化碳生成氢氧化铝
和碳酸氢钾:KAlO2+CO2+2H2O===KHCO3+Al(OH)3↓。
答案:(1)硝酸银溶液 (2)2KClO3CuO△2KCl+3O2↑ 3Cl2+6OH-5Cl-+ClO3-+3H2O
(3)Al3++3H2OAl(OH)3+3H+ (4)AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
2.下列实验报告记录的实验现象正确的是( )
|
实 验 |
 |
|
|
|
|
记 |
|
|
|
|
|
录 |
|
|
|
|
|
A |
无色 |
无色 |
无现象 |
无色溶液 |
|
B |
红色 |
无色 |
白色沉淀 |
白色沉淀 |
|
C |
红色 |
无色 |
无色溶液 |
白色沉淀 |
|
D |
无色 |
无色 |
无色溶液 |
无色溶液 |
易错分析:对SO2的漂白性原理未理解透彻或对SO2与Ba2+(Ca2+)反应必须在碱性环境下才能进行不
清晰导致错选A项或C项。
解析:SO2通入a中溶液显红色,SO2不能使其褪色;SO2通入b中溶液褪为无色;SO2通入c中使溶
液显酸性,相当于有了稀硝酸,必然有SO42-生成,所以c中肯定有白色沉淀生成;SO2通入d中发
生了反应SO2+2OH-+Ba2+=BaSO3↓+H2O,所以有白色沉淀生成。
答案:B
1.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
易错分析:不能够正确分析出当X是强酸时,A必是硫化物(如Na2S)而导致错选。
F可分别为Na2S→F可分别为Na2S→H2S→S→SO2→SO3→H2SO4,而此时C单质在常温下是固体;当X是强碱时,A→F可分别为NH4Cl→NH3→N2→NO→NO2→HNO3。
答案:D
5.(2010·模拟题)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品
工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等。化学兴趣小组在实验
室对Y中硫元素的价态进行探究:①将过量的稀硝酸加入少许样品中,振荡;②取
少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀。甲认为不能由此确定Y中硫
的价态为+6价。
(1)上述实验中产生的沉淀是________。
(2)你认为甲的判断是否正确?答:________(填“正确”或“不正确”)。作出这种判
断的依据是
________________________________________________________________________。
(3)乙对Y中硫的价态作出三种猜想:①硫的价态是+6价;②硫的价态是+4价;
③硫的价态是+4价和+6价。请设计实验检验乙的猜想③是否正确,并按要求填写
下表。
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、胶头滴管和试管架;1 mol·L-1
H2SO4、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3、3% H2O2、0.5 mol·L-1 BaCl2溶液、
品红试纸、蒸馏水。
|
实验操作 |
预期现象及实验结论 |
|
|
|
解析:(1)、(2)略。(3)检验Y是否是亚硫酸盐与硫酸盐的混合物,必须先利用酸与
亚硫酸盐反应,检验生成的二氧化硫,然后检验硫酸盐。
答案:(1)硫酸钡(或BaSO4)
(2)正确 硝酸有强氧化性,无论样品中的硫是+4价还是+6价,加入稀硝酸和硝
酸钡后最终都有硫酸钡沉淀生成
(3)
|
实验操作 |
预期现象及实验结论 |
|
①取少许样品于试管中,加入足量的2 mol·L-1 HCl溶液,并将湿润的品红试纸置于试管口 ②往上述反应后溶液中再滴加0.5 mol·L-1 BaCl2溶液 |
品红试纸褪色(或不褪色),样品中含有(不含)+4价硫元素 有(无)白色沉淀生成,样品中含有(不含)+6价硫元素 |
|
易错点 |
一 |
 |
不能够熟练应用“---”氧化还原反应线或未足够重视O3、H2O2的 |
性质、SO2的特性、SO42-的检验等内容
4.(2010·北京-黄冈预测卷七)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2,
O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合
经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的
化学方程式
________________________________________、
________________________________________________________________________。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此
时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是
_______________________________________________________________________。
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的
相对分子质量为134,则其化学式为
_______________________________________________________________________。
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是
________________________________________________________________________。
(3)能用于测定硫酸尾气中SO2含量的是________(填字母)。
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
解析:(1)尾气中的SO2与NH3·H2O的反应:SO2+2NH3·H2O===(NH4)SO3,当SO2
继续通入则发生:(NH4)2SO3+SO2+H2O===2NH4HSO3。发生的氧化还原反应应是
SO32-、HSO3-被氧气氧化为SO42-;(2)在尾气与氨水反应所得到的高浓度溶液中主
要含NH4HSO3,加入的氨水或碳酸氢铵与NH4HSO3反应生成(NH4)2SO3。①导致溶
液温度降低的原因应是反应吸热。②Mr[(NH4)2SO3]=116,结合结晶水合物的相对分
子质量134,可知结晶水合物含1分子H2O,化学式为(NH4)2SO3·H2O。③(NH4)2SO3
易被氧气氧化,且对苯二酚或对苯二胺具有还原性,所以加入适量的对苯二酚或对苯
二胺等物质,其目的是防止亚硫酸铵被氧化;(3)可用于测定硫酸尾气中SO2含量的
试剂要求能够定量的与SO2反应,又要能够指示恰好反应的终点。酸性高锰酸钾溶
液完全吸收SO2后,溶液的紫色恰好褪色;碘的淀粉溶液完全吸收SO2后,溶液的
蓝色恰好褪去。
答案:(1)2H2SO3+O2===2H2SO4 2(NH4)2SO3+O2===2(NH4)2SO4 2NH4HSO3+
O2===2NH4HSO4 (2)①反应吸热 ②(NH4)2SO3·H2O ③防止亚硫酸铵被氧化
(3)BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com