
题目列表(包括答案和解析)
10、(2011石景山区9.)将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。)
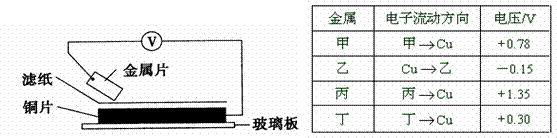
依据记录数据判断,下列结论中正确的是
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
9、(211海淀0模12)0关于下列各装置图的叙述中,不正确的是
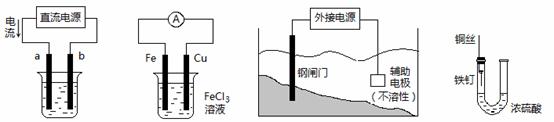
① ② ③ ④
 A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
8、(2011丰台区26(2)
③ 铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式: 。
答案③ SO32-+ 8H+ + 6e-= H2S↑+ 3H2O (2分)
7、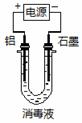 (2011海淀0模28 -(6))将该消毒液用如右图所示装置进行电解,10 s后将电解液摇匀,整个过程中阳极产生的现象为 ;其原因是 。
(2011海淀0模28 -(6))将该消毒液用如右图所示装置进行电解,10 s后将电解液摇匀,整个过程中阳极产生的现象为 ;其原因是 。
答案:(6)阳极产生白色沉淀,将电解液混合均匀,白色沉淀溶解 ………………………2分
铝为阳极,放电产生Al3+,消毒液中有过量OH-(且阴极H+不断放电,同时剩余OH-),故阳极附近先产生白色沉淀,将电解液混合均匀后,白色沉淀又溶解…2分
6、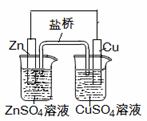 (2011丰台7.)下列叙述正确的是
(2011丰台7.)下列叙述正确的是
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2
C.氢氧燃料电池(酸性电解质)中O2通入正极,
电极反应为O2+4H++4e-=2H2O
D.右图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液
5、 (2011西城区25(4))WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如右图所示,a极的电极反应式是 。(WQ4Y:甲醇,Y2:O2)
(2011西城区25(4))WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如右图所示,a极的电极反应式是 。(WQ4Y:甲醇,Y2:O2)
答案(4)(2分)CH3OH- 6e-+ 8OH-=CO32-+ 6H2O
4、(2011海淀1模9.)查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
3、 (2011朝阳区8.)右图是探究铁发生腐蚀的装置图。发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升。下列说法不正确的是
(2011朝阳区8.)右图是探究铁发生腐蚀的装置图。发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升。下列说法不正确的是
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应均为:Fe - 2e- == Fe2+
D.析氢腐蚀的总反应为:2Fe + O2 + 2H2O == 2Fe(OH)2
2、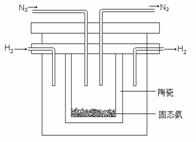 (2011门头沟区26.(2))(14分)
(2011门头沟区26.(2))(14分)
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
答案:⑵ N2 + 6H+ + 6e- = 2NH3
1、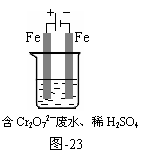 (2011东城一模28(2))工业可用电解法来处理含
(2011东城一模28(2))工业可用电解法来处理含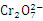 废水。实验室利用如图-23模拟处理含
废水。实验室利用如图-23模拟处理含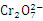 的废水,阳极反应式是Fe-2e-=Fe2+,阴极反应式是2 H+ +2e-=H2↑。Fe2+与酸性溶液中的
的废水,阳极反应式是Fe-2e-=Fe2+,阴极反应式是2 H+ +2e-=H2↑。Fe2+与酸性溶液中的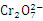 反应的离子方程式是 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是
。用电解法处理该溶液中0.01mol
反应的离子方程式是 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是
。用电解法处理该溶液中0.01mol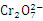 时,至少得到沉淀的质量是 g。
时,至少得到沉淀的质量是 g。
答案(2)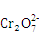 +6Fe2++14H+=2Cr3++6Fe3++7H2O,阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强。8.48
+6Fe2++14H+=2Cr3++6Fe3++7H2O,阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强。8.48
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com