
题目列表(包括答案和解析)
7.(2009·河北郑定中学模拟)A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图所示的转化关系(部分产物及反应条件已略去),下列判断正确的是
( )
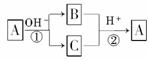
A.X元素可能为Al
B.X元素可能是金属,也可能是非金属
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
解析:A为单质,B、C为化合物,所以①、②一定为氧化还原反应,所以D正确;据这两个反应特点知A元素在①反应中化合价既升高,又降低,故A一定不是金属,A、B错误;①②不互为可逆反应,因为条件不同.
答案:D
6.(2009·江苏六校联考)某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
A.Al2O3 B.MgO
C.SiO2 D.P2O5
解析:该物质在过量的盐酸中可以得到白色沉淀,只有Na2SiO3符合,所以原氧化物为SiO2.选C.
答案:C
5.将总物质的量为n mol的钠与铝(其中钠的物质的量分数为x)投入到一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L.下列关系式中正确的是( )
A.x= B.0<x≤0.5
C.V=33.6n(1-x) D.11.2n<V≤22.4n
解析:该题中涉及的化学方程式为:2Na+2H2O===2NaOH+H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑.由题意,金属没有剩余可知x必大于或等于0.5,即0.5≤x<1.根据电子得失守恒得:×22.4=V(H2),当x=0.5时,V(H2)=22.4n,当x=1时,V(H2)=11.2n,则11.2n<V≤22.4n.
答案:D
4.(2009·四川阆中模拟)在下列操作过程中,发生的反应能用离子方程式Al3++3AlO+6H2O===4Al(OH)3↓表示的是
( )
A.向铝盐溶液中不断滴加NaOH溶液
B.向NaOH溶液中不断滴加铝盐溶液
C.向铝盐溶液中不断滴加小苏打溶液
D.向铝盐溶液中不断增加NaAlO2溶液
解析:由Al3++3AlO+6H2O===4Al(OH)3↓,可知该反应由可溶性Al3+和AlO盐反应而来,A、B是由Al3+和OH-反应,C是Al3+与HCO的双水解反应.
答案:D
3.某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH(aq),则消耗NaOH(aq)的体积(x轴)和生成沉淀量(y轴)之间的函数关系可用下图表示,其中正确的是
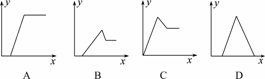
( )
解析:加入的NaOH首先中和H+,然后和Mg
2+、Al3+分别生成Mg(OH)2、Al(OH)3沉淀,最后过量的NaOH把Al(OH)3溶解生成NaAlO2.
答案:B
2.美、德两国科学家现已成功合成出具有独特化学特性的氢铝化合物(Al2H6).这一研究成果有助于人们开发出推力更强大的固体火箭燃料,也有望应用在氢动力汽车和其他能源方面.有关研究报告发表在最新出版的美国《科学》杂志上.下列关于氢铝化合物的推测不正确的是
( )
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.氢铝化合物中铝显+3价,H显-1价
C.铝与水蒸气在高温下生成氢铝化合物
D.氢铝化合物具有强还原性
解析:氢铝化合物类似于氢化钠、氢化钾等,其中金属铝显+3价,氢显-1价.铝在高温下与水蒸气反应生成氢氧化铝和氢气,不能得到氢化铝.
答案:C
1.以下有关正三价铝的叙述正确的是
( )
A.当向溶液中加入强酸溶液时,氢氧化铝主要发生酸式电离
B.当向溶液中加入强碱溶液时,氢氧化铝主要发生碱式电离
C.在强酸性环境中正三价的铝以Al3+形式存在于溶液中
D.在pH较大的溶液中正三价的铝以Al3+形式存在于溶液中
解析:Al(OH)3的电离:H++AlO+H2O Al(OH)3
Al(OH)3 Al3++3OH-.由平衡移动可知,加入强酸溶液H+中和OH-,应发生碱式电离生成Al3+,反之则发生酸式电离生成AlO.
Al3++3OH-.由平衡移动可知,加入强酸溶液H+中和OH-,应发生碱式电离生成Al3+,反之则发生酸式电离生成AlO.
答案:C
13.西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”.这是我国考古界、酿酒界的一个重大发现.
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究.
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿.
实验步骤:
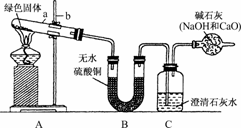
①对试管内的绿色固体进行加热,至完全分解.观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色.
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出.
④实验结论:绿色固体物质中含有________、________、________、________等元素.(提示:装置内的空气因素忽略不计)
(2)表达与交流:
①图中标有a、b的仪器名称是:a:________;b:________.
②上述实验步骤③中发生反应的离子方程式为______________________________.
③反应完成后,如果先移去酒精灯,可能出现的现象是________________________.
④如果将B、C两装置对调行吗?________.为什么?________________________.
解析:(1)B中无水CuSO4变蓝证明有H2O生成,C中澄清石灰水变浑浊证明有CO2生成,而②③证明黑色固体为CuO,故推断出绿色固体物质含有C、H、O、Cu等元素.
(2)①a为试管,b为铁架台.
②步骤③为Fe与CuSO4的反应.
③若先撤走酒精灯,则会发生倒吸.
④因B装置是检验有水生成,C装置检验有CO2气体生成,若二者对调,则无法证明是否有水生成.
答案:(1)④铜 碳 氢 氧
(2)①试管 铁架台
②Fe+Cu2+===Cu+Fe2+ ③C装置中的液体会倒流入B装置 ④不行 若对调,则无法证明加热绿色固体后是否有水生成
12.设计一个方案,在用廉价的原料和每种原料只用一次的条件下,分三步从含有Fe3+、Cu2+、Cl-和NO的废液中,把Fe3+转化为绿矾回收;把Cu2+转化为Cu回收.各步反应加入的原料依次是________.
各步反应的离子方程式是:
(1)____________________;
(2)____________________;
(3)____________________.
解析:这是一个将化学基础知识运用到实际生产中的问题,设计实施方案应用廉价的原料,简单易行. 依据题意应分三步实施.把Fe3+转化为绿矾回收,Cu2+―→Cu,完成此步可选用铁原料:2Fe3++Fe===3Fe2+、Fe+Cu2+===Cu+Fe2+.加铁前必须将Fe3+、Cu2+与Cl-、NO分离,可加碱使Fe3+―→Fe(OH)3↓,Cu2+―→Cu(OH)2↓,廉价的碱为Ca(OH)2.过滤后Fe(OH)3、Cu(OH)2又需转为盐溶液才能进行下一步反应,此方案实施只能用稀硫酸:2Fe(OH)3+3H2SO4===Fe2(SO4)3+6H2O,Cu(OH)2+H2SO4===CuSO4+2H2O.
答案:Ca(OH)2溶液、稀H2SO4、铁
(1)Fe3++3OH-===Fe(OH)3↓
Cu2++2OH-===Cu(OH)2↓
(2)Fe(OH)3+3H+===Fe3++3H2O
Cu(OH)2+2H+===Cu2++2H2O
(3)2Fe3++Fe===3Fe2+ Fe+Cu2+===Fe2++Cu
11.运用铁及其化合物的知识,完成下列各题.
(1)下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是
( )
A.盐酸 B.氯气
C.CuSO4溶液 D.稀硫酸
(2)既有氧化性、又有还原性的粒子是
( )
A.Fe B.Fe2+ C.Fe3+
(3)把过量的铁粉加入稀硝酸中,其结果是
( )
A.不反应
B.生成硝酸铵
C.生成硝酸亚铁
(4)要除去FeCl2溶液中的少量FeCl3,可行的办法是
( )
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D. 加入铁粉
(5)当人体缺铁时,往往需要吃补铁保健品.人体能够吸收的是+2价铁元素,但是+2价铁元素很容易被氧化.查看一种补铁保健品,了解其中铁元素的价态.
①你认为可以采用什么方法检验补铁剂中铁元素的价态?
a.________________________________.
b.________________________________.
②天然食品中含有的大多是+3价铁元素,为了使+3价铁元素转化为+2价铁元素并被人体较好地吸收,你认为应该采取哪些措施?请查找资料,寻找办法.
解析:(1)铁跟盐酸、稀硫酸、CuSO4溶液反应后得到+2价铁离子,铁跟氯气反应生成FeCl3,FeCl3与KSCN在水溶液中发生Fe3++3SCN-Fe(SCN)3(红色).选B.
(3)在过量铁粉存在条件下,不可能有Fe3+,因为Fe+2Fe3+===3Fe2+.溶液中铁元素的存在形式只可能有Fe2+.答案为C.
(4)除杂的原则是:除去杂质而不引入新的杂质. 若滴入KSCN溶液,不能除去Fe3+而引入了K+、SCN-等杂质离子,A选项不正确;通入氯气,发生反应:2FeCl2+Cl2===2FeCl3,不符合题意,B选项不正确;加入铜粉,Cu+2Fe3+===Cu2++2Fe2+,溶液中增加了Cu2+,该方法错误;加入铁粉,Fe+2Fe3+===3Fe2+,该方法可行.答案为D.
(5)①检验铁元素的价态,可以考虑先观察其水溶液颜色的方法:含Fe2+的溶液为浅绿色,含Fe3+的溶液为棕黄色.然后可以用和NaOH溶液反应或KSCN溶液反应观察产物颜色的方法鉴别检验:Fe2+与NaOH生成不稳定的白色絮状沉淀Fe(OH)2,该白色沉淀暴露在空气中会迅速转变成灰绿色,最后变为红褐色沉淀Fe(OH)3,Fe2+和KSCN溶液作用没有颜色变化;而Fe3+与NaOH溶液直接生成红褐色沉淀Fe(OH)3或与KSCN溶液作用呈红色.
②为使铁元素被人体较好地吸收,即要将+3价铁元素还原为+2价铁元素,可以考虑加还原剂,但该还原剂必须对人体健康无害,如加入Fe粉.
答案:(1)B (2)B (3)C (4)D
(5)①a.取少量样品制成溶液,若溶液呈浅绿色为Fe2+;若溶液呈棕黄色为Fe3+.b.取少量样品制成溶液,滴入NaOH溶液,若产生红褐色沉淀为Fe3+;若生成白色絮状沉淀,沉淀立即变灰绿最后变红褐色为Fe2+.c.取制成溶液滴入KSCN溶液,若溶液变红色为Fe3+,不变色为Fe2+.(三种方案任选两种) ②加入铁粉等还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com