
题目列表(包括答案和解析)
10.某研究性学习小组为了检验硫酸亚铁铵晶体中含有NH、Fe2+、SO和H2O,设计了如下实验步骤:①取少量晶体放在试管内,用酒精灯加热试管口有液体产生,说明晶体中含有水;②将加热后剩余的晶体溶解于水,加入用盐酸酸化过的氯化钡溶液,有白色沉淀生成,说明晶体中含有SO;③滤去白色沉淀,向滤液中加入过量的浓氢氧化钠溶液,加热,有能使红色石蕊试纸变蓝的气体产生,说明晶体中含有NH;④向步骤③的剩余液体中加入KSCN溶液,无明显变化,再加入少量氯水,溶液变红色,说明晶体中含有亚铁离子,其中不能达到实验目的的是
( )
A.①③④ B.①④ C.③④ D.④
解析:①能证明晶体中含有水;②是SO的检验,正确;③中产生使红色石蕊试液变蓝的气体一定为NH3,证明晶体中有NH,③正确,但在该过程中加入过量的浓NaOH溶液,则Fe2+完全被OH-沉淀,因此④不能达到实验目的,故选D.
答案:D
9.(2009·江南十校高三联考)氧化铁和氧化铜混合物m g,加3 mol/L盐酸溶液100 mL,恰好完全溶解,若m g的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为
( )
A.(m-1.6) g B.(m-2.4) g
C.(m-3.2) g D.无法确定
解析:依题意加入3 mol/L盐酸溶液100 mL,恰好完全溶解,则生成氯化铁和氯化铜,氯离子的物质的量为0.3 mol,利用“价态替换”,即这些金属离子与氧原子结合,则需氧原子0.15 mol,即m g金属氧化物中含有0.15 mol氧原子,故金属共有(m-2.4) g.
答案:B
8.(2009·德州检测)在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水.以下叙述正确的是
( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C.还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3∶2∶3
D.明矾属于硫酸盐,含结晶水,是混合物
解析:A项铝热剂是难熔金属氧化物和铝组成的混合物,不一定是由三氧化二铁和铝组成;B项检验三氧化二铁的操作步骤为:样品→粉碎→加盐酸溶解→滴加KSCN溶液;D项明矾含有结晶水,但是纯净物;在还原Fe2O3时,1 mol H2失去2 mol电子,1 mol Al失去3 mol电子,1 mol CO失去2 mol电子,所以据得失电子守恒即可判断C正确.
答案:C
7.某同学设计下列方法对A盐的水解液进行鉴定:
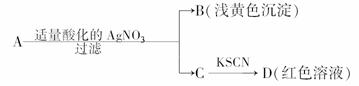
由此得出的结论中,不正确的是
( )
A.D溶液中存在Fe(SCN)3
B.滤液中有Fe3+
C.B为AgBr
D.A一定为无氧酸盐FeBr2
解析:根据B、D现象可确定A是由Fe3+和Br-或由Fe2+和Br-组成的盐.
答案:D
6.a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
( )
A.1∶7 B.7∶1 C.7∶8 D.8∶7
解析:根据题意,设与CuSO4反应的铁为x mol,与H2SO4反应的铁为y mol,
Fe+CuSO4===FeSO4+Cu
x x
Fe+H2SO4===FeSO4+H2↑
y
可以得出下列关系式:56(x+y)=64x
解得x∶y=7∶1.
答案:B
5.在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是
( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
解析:本题可据离子共存来判断,因为Fe粉过量,则无Fe3+、Cu2+、H+,故选C.
答案:C
4.某稀溶液中含有Fe(NO3)2、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示,则稀溶液中Fe(NO3)2、Cu(NO3)2、HNO3物质的量浓度之比为
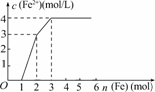
( )
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
解析:加入Fe粉的过程中发生的反应依次为:
Fe+4HNO3===Fe(NO3)3+NO↑+2H2O ①
Fe+2Fe3+===3Fe2+ ②
Fe+Cu2+===Fe2++Cu ③
铁粉加至1 mol前是与HNO3反应,由反应①知原溶液中HNO3为4 mol(生成1 mol Fe3+).铁粉从1 mol到2 mol时是与Fe3+反应,消耗2 mol Fe3+,据反应②知原有的Fe(NO3)2为2 mol-1 mol.铁粉从2 mol到3 mol时,由反应③得其中1 mol Fe 消耗Cu2+ 1 mol,所以Fe(NO3)2、Cu(NO3)2、HNO3物质的量浓度之比为1∶1∶4.
答案:D
3.(2009·长春高中毕业班测试)用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否.下列类推结论中正确的是
( )
A.Na失火不能用CO2灭火,K失火不能用CO2灭火
B.工业上电解熔融MgCl2制取金属镁,也用电解熔融AlCl3的方法制取金属铝
C.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
解析:AlCl3为共价化合物,熔融状态不导电,故不能用电解熔解AlCl3的方法制取金属铝;Fe与S直接化合只能生成FeS;Pb3O4中铅的化合价分别为+4价和+2价,故Pb3O4应写成2PbO·PbO2的形式.
答案:A
2.下列离子方程式书写正确的是
( )
A.铝粉投入到NaOH溶液中:
2Al+2OH-===2AlO+H2↑
B.AlCl3溶液中加入足量的氨水:
Al3++3OH-===Al(OH)3↓
C.三氯化铁溶液中加入铁粉:
Fe3++Fe===2Fe2+
D.FeCl2溶液跟Cl2反应:
2Fe2++Cl2===2Fe3++2Cl-
解析:离子反应方程式必须符合反应原理,铝与强碱溶液的反应中,氧化剂是水而不是碱,A错;氨水是弱碱不能写成离子形式,B错;离子方程式必须符合质量(原子个数)守恒和离子总电荷守恒,所以C错.
答案:D
1. 下列物质反应后一定有+3价铁生成的是
( )
①过量的Fe与Cl2反应
②Fe与过量稀H2SO4反应后,再向其中加入KNO3
③Fe和Fe2O3的混合物溶于盐酸中
A.① B.①③
C.①② D.全部
解析:虽然铁粉过量,但铁与Cl2发生反应的产物为FeCl3,故①中有+3价铁生成;Fe与稀H2SO4反应生成FeSO4,当溶液中有H+存在时,NO会将Fe2+氧化生成Fe3+,故②中有+3价铁生成;Fe和Fe2O3的混合物溶于盐酸中时,若铁粉很多,则过量的铁粉与生成的FeCl3发生反应生成FeCl2,而使溶液中无Fe3+,故③中不一定有+3价铁生成,所以选C.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com