
题目列表(包括答案和解析)
7、(2011门头沟区25.)(14分)
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
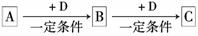
⑴若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
⑵若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为 。
⑶若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
⑷若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为 。
⑸若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 。
⑹若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为 。
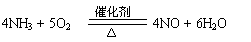
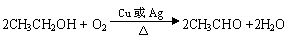
⑺若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式为 。
 答案:25.(14分,每空2分)
答案:25.(14分,每空2分)
⑴
⑵ 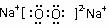
⑶ 加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe===3Fe2+
⑷ CO2 + CO32- + H2O = 2HCO3-
⑸ AlO2﹣
 ⑹
O=C=O
⑹
O=C=O
⑺
6、(2011门头沟区7.)已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是
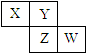 A.Z元素的原子半径可能比Y元素的小
A.Z元素的原子半径可能比Y元素的小
B.W的原子序数可能是Y的原子序数的2倍
C.W的气态氢化物的稳定性一定比Y的强
D.Z的化学活泼性一定比X强
5、 (2011东城一模9).根据已知条件,对物质的性质强弱判断不正确的是
(2011东城一模9).根据已知条件,对物质的性质强弱判断不正确的是
A.已知2C+SiO2 Si+2CO,说明非金属性:碳>硅
B. 已知相同条件下气态氢化物的稳定性HA>HB,说明还原性:A- < B-
C. 已知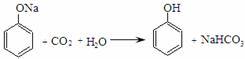 ,说明酸性:碳酸>苯酚
,说明酸性:碳酸>苯酚
D. 已知相同物质的量浓度MCl和NCl两种溶液中c(M+)>c(N+),说明碱性:MOH > NOH
4、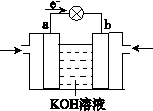 (2011西城区25(4))(14分) Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1∶1和1∶2的两种离子化合物。
(2011西城区25(4))(14分) Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1∶1和1∶2的两种离子化合物。
(1)W在元素周期表中的位置是 ,Z2Y的电子式是 。
(2)工业合成XQ3是放热反应。下列措施中,既能加快反应速率,又能提高原料转化率的是 。
a.升高温度 b.加入催化剂
c.将XQ3及时分离出去 d.增大反应体系的压强
(3)2.24 L(标准状况)XQ3被200 mL 1 mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是 。
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理
如右图所示,a极的电极反应式是 。
(5)已知:W(s)+ Y2 (g)= WY2(g) ΔH=-393.5 kJ/mol
WY(g)+ 1/2 Y2 (g)= WY2(g) ΔH=-283.0 kJ/mol
24 g W与一定量的Y2反应,放出热量362.5 kJ,所得产
物的物质的量之比是 。
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
答案4.(14分)
(1)(2分)第二周期IVA族
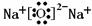 (2分)
(2分)
(2)(2分)d
(3)(2分)c(NO3-)>c(H+)>c(NH4+)>c(OH-)
(4)(2分)CH3OH- 6e-+ 8OH-=CO32-+ 6H2O
(5)(2分)n(CO2)∶n(CO)=1∶3
(6)(2分)Na3N + 4H2O=3NaOH + NH3·H2O
3、(2011海淀1模25.)(13分)甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。
用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入适量NaOH溶液,加热;
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是 ,D在周期表中的位置 。
(2)用离子方程式表示实验②中现象的原因: 。
(3)实验③中出现的现象是 。
(4)经测定甲晶体的摩尔质量为392 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
答案.(13分)
(1)Fe ………………………………………………………………………(1分)
第3周期 VIA族 ……………………………………………(2分)
(2)2Fe2++Cl2===2Cl-+2Fe3+ ……………………………………………(2分)
Fe3++3SCN-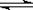 Fe(SCN)3(等号给分)
………………………(2分)
Fe(SCN)3(等号给分)
………………………(2分)
(3)有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色(2分),加热有大量刺激
性气味 气体生成(或有能使湿润的红色石蕊试纸变蓝的气体生成,2分)。
…………………………………………………………………(共4分)
(4)(NH4)2Fe(SO4)2·6H2O ………………………………………………(2分)
[或Fe(NH4)2(SO4)2·6H2O,未写出结晶水给1分]
2、(2011海淀1模10.) X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图3所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
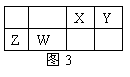 A.Y元素最高价氧化物对应的水化物化学式为H3YO4
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X< Z < Y <W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X、Z两种元素的氧化物中所含化学键类型相同
1、(2011朝阳区7.)X、Y、Z、W均为短周期元素,在周期表中位置如图所示。Y原子的最外层电子数是电子层数的3倍。下列说法中不正确的是
A.Y、Z的气态氢化物,前者更稳定
B.Z、W的最高价氧化物对应水化物的酸性,前者强
C.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键
D.Y、W的单质,均可通过电解的方法获得
3.电解原理与金属防腐
将铝制品与另一材料作电极,以某种溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3 薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量,使Al(OH)3 分解,从而在铝制品表面 形成一层较厚的氧化膜。某校研究性小组根据上述原理,以铝制品和铁棒为电极,以一定浓度的碳酸氢钠溶液为电解液进行实验
形成一层较厚的氧化膜。某校研究性小组根据上述原理,以铝制品和铁棒为电极,以一定浓度的碳酸氢钠溶液为电解液进行实验 。
。
(1)铝制品表面形成氢氧化铝薄膜的电极反应式为________ ________________________
________________________
(2)电解过程中必须使电解液的PH保持相对稳定(不能太大,也不能太小)的原因是___
____________________________________
解析:本题的命题背景是利用电解原理在铝制品表面形成氧化膜,增强铝制品的抗腐蚀能力。
(1)要形成Al(OH)3
薄膜,铝制品 需做阳极:Al -3e- =Al3+ ,然后Al3+与溶液中的
需做阳极:Al -3e- =Al3+ ,然后Al3+与溶液中的
HCO3-水解反应:Al3+ +3HCO3- =Al(OH)3 + 3CO2 .
总的电极反应式为:Al -3e-+ 3HCO3- =Al(OH)3 + 3CO2 .
(2)Al (OH)3
和Al2O3都是两性物质,
(OH)3
和Al2O3都是两性物质, 电解液酸性或碱性太大会使形成的Al2O3薄膜溶解,因此必须使
电解液酸性或碱性太大会使形成的Al2O3薄膜溶解,因此必须使 电解液的PH保持相对稳定。
电解液的PH保持相对稳定。
2.电解原理与废水处理
工业上处理含Cr2O72- 酸性工业废水用以下方法:(1)往工业废水中加入适量的NaCl,搅拌均匀;(2)以Fe为电极进行电解,经过一段时间有Cr(OH)3 和Fe(OH)3 沉淀产生;(3)过滤,回收,沉淀,废水达到排放标准,试回答:
(1)电解时的电极反应:阳极________________ 阴极________________
(2)电解过程中Cr(OH)3 和Fe(OH)3 沉淀是怎样产生的?___________________
(3) 能否将铁电极改为石墨电极?为什么?_________ _______________________
_______________________
解析:根据电解原理可判断:阳极为活泼电极Fe,发生氧化反应:Fe -2e- = 2Fe2-,废水中的H+ 浓度增大,阴极发生还原反应:2H + +2e- = H2 ↑.在酸性溶液中,阳极溶解下来的Fe2+ 将Cr2O72- 还原成Cr3+,自身被氧化成Fe3+,随着电解的不断进行,c(H+)减小,Cr3+,Fe3+ 在溶液中的水解程度增大,
+ +2e- = H2 ↑.在酸性溶液中,阳极溶解下来的Fe2+ 将Cr2O72- 还原成Cr3+,自身被氧化成Fe3+,随着电解的不断进行,c(H+)减小,Cr3+,Fe3+ 在溶液中的水解程度增大, 以至从溶液中析出Cr(OH)3 和Fe(OH)3 沉淀,废水中加入适量的NaCl,是为增强溶液的导电性。若将 Fe 电极改成石墨电极(惰性电极),则溶液中的Cl-在阳极放电:2 Cl- -2e- =Cl2↑,溶液中无Fe2-,也就是无法将废水中的Cr2O72- 还原而除去。
以至从溶液中析出Cr(OH)3 和Fe(OH)3 沉淀,废水中加入适量的NaCl,是为增强溶液的导电性。若将 Fe 电极改成石墨电极(惰性电极),则溶液中的Cl-在阳极放电:2 Cl- -2e- =Cl2↑,溶液中无Fe2-,也就是无法将废水中的Cr2O72- 还原而除去。
1. 电解食盐水与杀菌消毒
某学生想 制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化纳溶液,通电时,为使Cl2
被完全吸收,制得有较强杀菌能力的消毒液,设计了如图1所示的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化纳溶液,通电时,为使Cl2
被完全吸收,制得有较强杀菌能力的消毒液,设计了如图1所示的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A.a为正极,b为负极;NaClO 和NaCl
B. a为负极,b为正极;NaClO 和NaCl
C. a为阳极,b为阴极;HClO 和NaCl
D. a为阴极,b为阳极;HClO 和NaCl

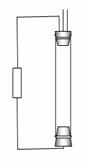

解析:用石墨作电极电解饱和NaCl 溶液总电极反应式为:2NaCl + 2H2O=2NaOH +H2↑ +Cl2 ↑,反应产物又可继续反应:2NaOH +Cl2
=NaCl + NaClO + H2O
,由此可知有较强杀菌能力的消毒液主要成分为NaClO和NaC l.电解过程中阴极产生H2和NaOH,阳极产生Cl2,为使产生的Cl2与NaOH 溶液充分接触并反应,显然应该是电解池的下端产生Cl2
,即上端a为负极,下端b为
l.电解过程中阴极产生H2和NaOH,阳极产生Cl2,为使产生的Cl2与NaOH 溶液充分接触并反应,显然应该是电解池的下端产生Cl2
,即上端a为负极,下端b为 正极。
正极。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com