
题目列表(包括答案和解析)
7.下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2 KSCN NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO3 Na2SiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2 (AgNO3溶液)
D.(NH4)3PO4 NaBr CuSO4 AlCl3 (KOH溶液)
解析:A项先用FeCl3溶液鉴别出Ba(OH)2、KSCN,再用Ba(OH)2溶液可鉴别NaCl、Mg(NO3)2; B项中现象依次是无现象、有无色无味气体产生,有无色刺激性气味的气体产生,产生白色沉淀,可直接鉴别;C项无法区别K2CO3和CaCl2(与AgNO3溶液反应均产生白色沉淀;D项将KOH溶液加入4种溶液中,现象依次是:产生刺激性气体、无现象、产生蓝色沉淀、产生白色沉淀然后逐渐溶解,可直接鉴别.
答案:C
6.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①、②、③、④是
( )

A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
解析:Fe3+、Al3+都能与过量的NH3·H2O和NaOH溶液反应产生沉淀,Ba2+和Ag+均能与过量的H2SO4产生沉淀,因此要将5种离子彻底分离,应先加入NaCl,使Ag+沉淀,再加氨水,使Fe3+和Al3+沉淀,然后在沉淀中加NaOH溶液,使Al(OH)3溶解而与Fe(OH)3分离,在操作之后的溶液中加入H2SO4,使Ba2+产生BaSO4沉淀与K+分离,故答案为D.
答案:D
5.若NA表示阿伏加德罗常数的值,下列说法正确的是
( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
解析:Cl2作氧化剂时,还原产物为Cl-,所以1 mol Cl2得到2 mol电子,A错误;标准状况下,22.4 L H2是1 mol,氢原子为2NA个,B错误;14 g N2分子中含有的电子数为×14 NA=7NA,正确;NA个CO分子的质量为1 mol×28 g/mol=28 g,0.5 mol CH4的质量为0.5 mol×16 g/mol=8 g,所以二者的质量比为28 g∶8 g=7∶2,D错误.
答案:C
3.(2010·山东临沂月考)300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO的物质的量浓度为
( )
A.0.4 mol/L B.0.3 mol/L
C.0.2 mol/L D.0.1 mol/L
解析:n(Al3+)=1.62 g/27 g/mol=0.06 mol,n(SO)=0.09 mol.加入Ba(OH)2溶液中含Ba2+0.03 mol,剩余SO 0.06 mol,此时溶液的体积为600 mL,c(SO)=0.1 mol/L.
答案:D 4.下列装置或操作能达到实验目的的是
( )

解析:A项中集气瓶口塞有塞子,会发生爆炸危险,A错误;B项不符合构成原电池的条件,错误;C项中关闭止水夹,利用注水法检查装置气密性,正确;D项中CO2比空气重,应长管进气,短管出气,D错误.
答案:C
2.某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为了分别得到各含一种金属阳离子的沉淀,可采取:①通入H2S;②通入CO2,③加HCl溶液,④加NaOH溶液4个步骤,设试剂均过量,且每次都把所生成的沉淀过滤出来.其正确的操作顺序是
( )
A.③①④② B.①③④②
C.④②①③ D.④②③①
解析:四种粒子形成的沉淀分别为Fe(OH)2 、Al(OH)3、AgCl、CuS.
答案:A
1. 观察下图,若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是
( )

A.100 mL烧杯 B.50 mL烧杯
C.100 mL量筒 D.50 mL量筒
解析:此题以实验题面目出现,考查了烧杯和量筒两种常见仪器,对学生的能力要求不高,但有教育学生珍惜水资源的寓意.A和B两选项都是烧杯,它不能较精确地测量液体体积;要较精确地测量出1000×3%mL水的体积,应选50 mL量筒,即D.
答案:D
13.某同学用下图所示做水果电池的实验,测得数据如下表所示:

|
实验编号 |
电极材料 |
水果品种 |
电极间距/cm |
电压/mV |
|
|
1 |
锌 |
铜 |
菠萝 |
3 |
900 |
|
2 |
锌 |
铜 |
苹果 |
3 |
650 |
|
3 |
锌 |
铜 |
柑橘 |
3 |
850 |
|
4 |
锌 |
铜 |
西红柿 |
3 |
750 |
|
5 |
锌 |
铝 |
菠萝 |
3 |
650 |
|
6 |
锌 |
铝 |
苹果 |
3 |
450 |
请回答以下问题:
(1)实验6中负极的电极反应式为________.
(2)实验1、5中电流方向相反的原因是________.
(3)影响水果电池的电压的因素有________、________.
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再按发光二极管,这样做________.(填“合理”或“不合理”)
解析:(1)实验6中电极是Zn与Al,因Al更活泼,故负极反应为Al-3e-===Al3+.
(2)因实验1中锌比铜活泼,锌为负极;实验5中铝比锌活泼,锌为正极,故两实验中电流方向相反.
(3)由实验1和5可知,水果电池的电压与水果的品种及电极材料有关.
(4)这样做可使电压增大,合理.
答案:(1)Al-3e-===Al3+
(2)实验1中锌比铜活泼,锌为负极;实验5中锌比铝活泼性差,锌为正极,所以两实验中电流方向相反
(3)水果品种 电极材料 (4)合理
12.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
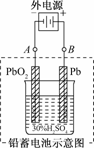 Pb+PbO2+4H++2SO
Pb+PbO2+4H++2SO 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g.
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________.
解析:(1)根据装置和电池反应判断:负极是Pb,正极是PbO2,放电时的电极反应为:
负极:Pb-2e-+SO===PbSO4
正极:PbO2+2e-+4H++SO===PbSO4+2H2O
反应中H2SO4不断被消耗,故浓度变小,又根据电极反应判断两极均有PbSO4生成,每转移1 mol电子,两极均有0.5 mol PbSO4生成,对于负极将增加0.5 mol SO,质量为96 g/mol×0.5 mol=48 g.
(2)按题图连接后,变为电解池,A极上发生的反应为PbSO4+2e-===Pb+SO,而B极上发生的反应为PbSO4+2H2O-2e-===PbO2+4H++SO,故A、B两极上将分别生成Pb和PbO2,且工作时蓄电池正负极的极性已对换.
答案:(1)PbO2+2e-+4H++SO===PbSO4+2H2O 小 48
(2)Pb PbO2 对换
11.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2===2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为________________,
②正极反应式为________________,
③工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(2)如把KOH改为稀H2SO4作电解质,则:
①负极反应式为________________,
②正极反应式为________________,
③工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为____________________.
解析:(1)电解质为KOH溶液时,溶液呈碱性,负极反应中H2生成H+,而H+不能与OH-共存;另外正极反应中O2在碱性溶液中只能生成OH-.
负极反应:2H2+4OH--4e-===4H2O
正极反应:O2+2H2O+4e-===4OH-,方程式为:2H2+O2===2H2O,所以工作一段时间后,溶液的pH减小.
(2)电解质为H2SO4时,溶液呈酸性,负极反应中H2生成H+,H+能与硫酸根离子共存;另外正极反应中O2在酸性溶液里只能生成水.
负极反应:2H2-4e-===4H+
正极反应:O2+4H++4e-===2H2O,同样总反应为2H2+O2===2H2O,工作一段时间后,溶液pH增大.
(3)电解质为KOH溶液,正极上反应的物质是O2,所以H2O必须写入反应式中,O2生成OH-.
正极反应:O2+2H2O+4e-===4OH-
答案: (1)①2H2+4OH--4e-===4H2O ②O2+2H2O+4e-===4OH- ③减小
(2)①2H2-4e-===4H+ ②O2+4H++4e-===2H2O ③增大
(3)O2+2H2O+4e-===4OH-
10.将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量CuSO4溶液.下图表示产生氢气的体积V与时间t的关系,其中正确的是
( )
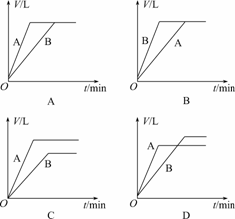
解析:在A中加入少量CuSO4,则有少量Zn置换铜,从而构成锌铜原电池,使反应速率增大,这样与H2SO4反应产生H2的Zn的量减小,所以产生H2的体积减小,故D符合.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com