
题目列表(包括答案和解析)
9.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)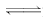
 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
( )
A.2 mol C
B.2 mol A, 1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol A, 3 mol B和3 mol C
解析:因该反应是一个气体体积不变的反应,因此只要n(A)∶n(B)=1∶1即为等效平衡,因此将选项中各种配比全部转化为起始时A和B的物质的量并与题给平衡进行逐一分析:
起始物质的量(mol 2A(g)+B(g)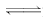
 3C(g) 平衡时φ(A)
3C(g) 平衡时φ(A)
已知 2 2 0 a%
A 0 >a%
B 2 1 0 >a%
C 0 <a%
D 4 4 0 =a%
所以选A、B.
答案:AB
8.一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)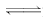
 2SO3(g),达到平衡后改变下述条件,SO3平衡浓度不改变的是
2SO3(g),达到平衡后改变下述条件,SO3平衡浓度不改变的是
( )
A.保持温度和容器体积不变,充入1 mol SO3(g)
B.保持温度和容器内压强不变,充入 1mol SO3(g)
C.保持温度和容器内压强不变,充入1 mol SO2(g)
D.保持温度和容器内压强不变,充入1 mol Ar(g)
解析:A项温度和体积不变,充入1 mol SO3(g),相当于增大了体系的压强,平衡要移动.B项温度和压强不变,充入1 mol SO3(g),相当于加入1 mol SO2和0.5 mol O2,最终可建立等效平衡.C项温度和压强不变,充入1 mol SO2(g),体积增大,平衡要移动.D项温度和压强不变,充入1 mol Ar(g),相当于减压,平衡要移动.
答案:B
7.(2009·黄冈模拟)在体积恒定的密闭容器中,充入 3 mol A和1
mol B发生反应:3A(g)+B(g)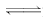
 xC(g),达到平衡后,C在平衡混合气体中的体积分数为φ.若维持温度不变,按1.2 mol A、0.4 mol B、0.6
mol C为起始物质,达到平衡后压强不变,C的体积分数仍为φ,则x值是
xC(g),达到平衡后,C在平衡混合气体中的体积分数为φ.若维持温度不变,按1.2 mol A、0.4 mol B、0.6
mol C为起始物质,达到平衡后压强不变,C的体积分数仍为φ,则x值是
( )
A.2 B.1
C.3 D.4
解析:本题的条件是恒容装置,现在起始物质不同物质的量的前提下要求达到平衡时C物质的体积分数φ相等且压强不变,压强不变即物质的量不变,因此属于“等同平衡”,必须用回归定值法,即1.2 mol+3×0.6 mol/x=3 mol, 0.4 mol+0.6 mol/x=1 mol,解得x=1.
答案:B
6.反应aA(g)+bB(g)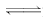
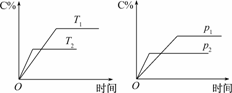
 cC(g) ΔH=Q kJ/mol,生成物C的质量分数与压强p和温度的关系如下图,方程式中的化学计量数和Q值符合图象的是
cC(g) ΔH=Q kJ/mol,生成物C的质量分数与压强p和温度的关系如下图,方程式中的化学计量数和Q值符合图象的是
( )
A.a+b<c Q>0 B.a+b>c Q<0
C.a+b<c Q<0 D.a+b=c Q>0
解析:由温度-时间图象判断,T2>T1(因为温度越高,反应速率越快,达到平衡所需时间越短),从T1→T2,即升温,C%降低,则正反应为放热反应,即Q<0;由压强-时间图象判断,p2>p1(因为压强越大,反应速率越快,达到平衡所需时间越短),从p1→p2,加压,C%降低,平衡逆向移动,即逆反应是气体体积缩小的反应,则有a+b<c,故选C.
答案:C
5.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)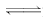
 2HBr(g) ΔH<0,平衡时 Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b.a与b的关系是
2HBr(g) ΔH<0,平衡时 Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b.a与b的关系是
( )
A.a>b B.a=b
C.a<b D.无法确定
解析:该反应为放热反应,所以在绝热条件下,随着反应的进行,体系温度升高,与恒温下的平衡相比,因为绝热条件下的温度高,平衡左移,因此a>b.
答案:A
4.下列关于判断过程的方向的说法正确的是
( )
A.所有自发进行的化学反应都是放热反应
B.高温高压下可以使石墨转化为金刚石是自发的化学反应
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固、液、气三种状态的熵值相同
解析:自发进行只能用来判断过程的方向,而不能判断反应的热效应,A项错;高温高压的条件下,低能量的石墨转化为高能量的金刚石,是一个非自发的化学反应,B项错;同一物质的固、液、气三种状态中,气态的混乱度最大,熵值最大,D项错.
答案:C
3.高温下,某反应达到平衡,平衡常数K=.恒容时,温度升高,H2浓度减小.下列说法正确的是
( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O CO2+H2
CO2+H2
解析:由题中平衡常数的表达式可知该反应为:CO2(g)+H2(g)  CO(g)+H2O(g),D项错误;升高温度,H2浓度减小,说明平衡向右移动,该反应的正反应为吸热反应,A项正确;该反应为反应前后气体体积不变的反应,增大压强对该反应的平衡无影响,增大压强氢气浓度相应增大,B项错误;对任何反应来说,升高温度反应速率都增大,C项错误.
CO(g)+H2O(g),D项错误;升高温度,H2浓度减小,说明平衡向右移动,该反应的正反应为吸热反应,A项正确;该反应为反应前后气体体积不变的反应,增大压强对该反应的平衡无影响,增大压强氢气浓度相应增大,B项错误;对任何反应来说,升高温度反应速率都增大,C项错误.
答案:A
2.硝酸生产工艺中,在吸收塔里发生如下反应:3NO2+H2O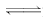 2HNO3+NO(正反应为放热反应),为提高NO2的转化率,理论上应该采取的措施是
2HNO3+NO(正反应为放热反应),为提高NO2的转化率,理论上应该采取的措施是
( )
A.减压 B.增压
C.升温 D.加催化剂
解析:该反应为气体体积减小的反应,且放热,为提高NO2的转化率,可采用增大压强或降低温度的方法.
答案:B
1.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)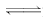 NH3(g)+HI(g)
NH3(g)+HI(g)
②2HI(g)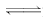 H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5 mol/L,c(HI)=4 mol/L,则此温度下反应①的平衡常数为
( )
A.9 B.16
C.20 D.25
解析:根据题意
2HI(g)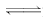 H2(g)+I2(g)
H2(g)+I2(g)
平衡浓度:4 mol/L 0.5 mol/L
起始浓度:c(HI)=平衡量+变化量
=4 mol/L+0.5 mol/L×2=5 mol/L
则c(NH3)=c(HI)起始浓度=5 mol/L
根据平衡常数定义:K=c(NH3)·c(HI)
=5 mol/L×4 mol/L=20 (mol/L)2,故C项正确.
答案:C
22.(10分)T℃时,有甲、乙两个密闭容器,甲容器的体积为1
L,乙容器的体积为2
L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g)
 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4
mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4
mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________,化学方程式中计量数b=________.
(2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”),原因是______________________________.
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,则还需加入A、B的物质的量分别是________、________.
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是________.
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(5)写出平衡常数表达式K=________,并计算在T℃时的化学平衡常数K=________.
解析: 3A(g)+bB(g)
 3C(g)+2D(g) ΔH<0
3C(g)+2D(g) ΔH<0
起始浓度(mol/L) 6 3 0 0
转化浓度(mol/L) 3.6 1.2 3.6 2.4
平衡浓度(mol/L) 2.4 1.8 3.6 2.4
(1)甲容器中反应的平均速率v(B)=Δc/t=0.3 mol/(L·min),化学反应中各物质的物质的量之比等于化学方程式计量数之比,所以3∶b=3.6∶1.2,所以b=1.
(2)甲、乙容器中投入的A、B物质的量相等,但乙的体积是甲的2倍,所以乙中反应物的浓度小,反应速率小;并且达到平衡时,乙容器中B的剩余物质的量少,即乙容器中反应程度大,所以乙容器达到平衡所需时间大于甲容器,即大于4 min.
(3)本题属于等效平衡问题,在恒温、恒容条件下,要使乙容器达到平衡后,B的浓度仍然为0.8 mol/L,则丙和乙是等效平衡.处理的方法是:如果根据化学方程式中计量数之比换算到同一边时,反应物(或生成物)中同一组分的物质的量完全相同,则互为等效平衡.将3 mol C、2 mol D,按化学方程式计量数折算到左边,则A为3 mol,B为1 mol,要和乙容器中的6 mol A和3 mol B相同,还需要加入3 mol A和2 mol B.
(4)通过分析甲、乙容器中B的物质的量浓度,可知B中反应程度大,要使甲、乙容器中B的平衡浓度相等,需使甲的平衡向右移动;根据化学反应的特点,可以采取减压、降温,或则增加反应物A,所以A、C项符合要求.
(5)根据(1)中求出的b=1,可知化学反应方程式为:3A(g)+B(g)3C(g)+2D(g),平衡常数的表达式为:K=,将各物质的平衡浓度代入上式可得:
K==10.8 mol/L.
答案:(1)0.3 mol/(L·min) 1
(2)大于 乙容器的体积大于甲容器的体积,浓度减小 ,反应速率减慢,达平衡所需时间长
(3)3 mol 2 mol (4)AC
(5) 10.8 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com