
题目列表(包括答案和解析)
1.下列说法正确的是
( )
A.活化分子碰撞即发生化学反应
B.升高温度会加快反应速率,其原因是增加了活化分子碰撞的次数
C.某一反应的活化分子的百分数是个定值
D.活化分子间的碰撞不一定是有效碰撞
解析:A项活化分子间的有效碰撞才能发生化学反应;B项升高温度增大了活化分子的百分数,从而增加有效碰撞的次数;C项活化分子的百分数受温度影响;D项活化分子间能发生反应的碰撞为有效碰撞.
答案:D
13.在一个小烧杯里,加入 20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有4-5滴水的玻璃片上.然后加入10g NH4Cl晶体,并用玻璃棒迅速搅拌.如下图所示.

回答下列问题:
(1)实验中玻璃棒的作用是______________________________;
(2)反应方程式是____________________,该反应属于________(填反应类型);
(3)实验中观察到现象有____________________;反应混合物呈糊状的原因是________________________;
(4)通过________现象,说明该反应为________热反应,这是由于反应物的总能量________生成物的总能量.
解析:该反应是吸热反应,吸收热量后造成烧杯和玻璃片间的水凝结成冰致使烧杯和玻璃片粘在一起,由于反应过程中有水生成,使固体混合物呈糊状.
答案:(1)搅拌使混合物充分接触并起反应
(2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O 复分解反应
(3)玻璃片上结冰而与小烧杯粘结在一起 反应发生时有水生成 (4)结冰 吸 小于
12.“嫦娥一号”探月成功,实现了中国人“奔月”的梦想.
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点除产生的热量大之外,还具有的优点是____________________.
(2)下列是298 K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ/mol
C(g)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5518 kJ/mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是________.
(3)已知:H2(g)===H2(l) ΔH=-0.92 kJ/mol
O2(g)===O2(l) ΔH=-6.84 kJ/mol
H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式____________________________.如果此次“嫦娥一号”所携带的燃料为1.08吨,液氢、液氧恰好完全反应生成气态水,总共释放能量________kJ(保留3位有效数字).
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应为:
负极放电的物质为________,
正极:______________________________,
总反应式:__________________________.
解析:(1)因产物只有H2O,不污染成为这种推进剂的优点.
(2)假设都为1 g物质,H2放出热量kJ=142.9kJ;C放出热量为:=32.79 kJ;C8H18放出热量为:=48.40 kJ;CH4放出热量为=55.64 kJ.故放出热量最多的是H2.
(3)由①H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ/mol
②H2(g)===H2(l) ΔH=-0.92 kJ/mol;
③O2(g)===O2(l) ΔH=-6.84 kJ/mol;
④H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
①-②-③×+④得
H2(l)+O2(l)===H2O(g) ΔH=-237.46 kJ/mol.
若携带1.08吨燃料,又完全生成气态水,则m(H2)∶m(O2)=1∶8,即H2有0.12吨,H2的物质的量为=6×104 mol,放出能量为6×104×237.46 kJ=1.42×107 kJ.
(4)负极失电子的物质是H2.
正极:O2+2H2O+4e-===4OH-
总反应式:2H2+O2===2H2O
答案:(1)产物为水,无污染 (2)H2
(3)H2(l)+O2(l)===H2O(g) ΔH=-237.46 kJ/mol 1.42×107
(4)H2 O2+2H2O+4e-===4OH-
2H2+O2===2H2O
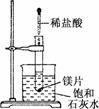
11.如右图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5 mL 盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是____________________________.
(2)产生上述现象的原因是
_________________________________________________________________________.
(3)写出有关反应的离子方程式:____________________.
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量.
解析:Mg与盐酸反应时产生H2,同时放出热量,使小试管及饱和石灰水的温度升高,而Ca(OH)2在水中的溶解度随温度的升高而减小,故会析出晶体,发生离子反应为 Mg+2H+===Mg2++H2↑,因该反应为放热反应,知道MgCl2溶液和H2的总能量要比Mg片和盐酸的总能量要小.
答案:(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体
(2)镁与盐酸反应产生氢气,该反应为放热反应,
Ca(OH)2在水中的溶解度随温度升高而减小,故析出
Ca(OH)2晶体
(3)Mg+2H+===Mg2++H2↑ (4)小于
10.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=+49.0 kJ/mol
②CH3OH(g)+O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ/mol
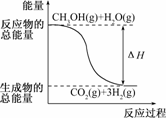
下列说法正确的是
( )
A.CH3OH的燃烧热为 192.9 kJ/mol
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
解析:燃烧热是在室温、101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量,显然A不正确;反应①为吸热反应,则反应物的总能量应低于生成物的总能量,所给图示不正确,即B不正确;反应①为吸热反应,反应②为放热反应,二者皆可使CH3OH转化为H2,C不正确;由于在CH3OH(l)―→CH3OH(g)过程中需吸收热量,故D正确.
 答案:D
答案:D
9.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
( )
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O+2NH4Cl(s)===BaCl2(aq)+
2NH3·H2O(l)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g)
ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
解析:只有氧化还原反应才有电子的转移,故放热的氧化还原反应在理论上可设计成原电池,A、B为吸热反应,C为非氧化还原反应,故选D.
答案:D
8.(2009·广州六校联考)化学反应中通常伴随着能量变化,下列说法中错误的是
( )
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
解析:本题考查化学反应与能量变化.B项中电解熔融Al2O3是将电能转化为化学能.
答案:B
7.在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化.据此判断以下叙述错误的是
( )
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来
C.氮分子内部存在着很强的共价键,故通常状况下氮气化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应
解析:Na与Cl2反应是放热反应,能量降低,A项正确;物质燃烧放热,化学能转化为热能,B项正确;氮分子内部存在着很强的共价键,很难被破坏,所以在通常状况下氮气的化学性质很稳定,C项错误;任何化学反应都经历了旧键断裂(吸收能量)和新键形成(释放能量)的过程,都伴随着能量的变化,但释放能量还是吸收能量,不是由反应条件决定的,如合成氨需要在高温下进行,但它却是释放能量的反应,D项正确.
答案:C
6.下列说法或表示方法正确的是
( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由石墨比金刚石稳定可知:C(金刚石,s)===C(石墨,s) ΔH<0
D.在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol
解析:反应物的总能量低于生成物的总能量时,可以通过吸热使反应发生;强酸与强碱反应放出的热量不一定为中和热,如浓硫酸反应过程中首先溶于水要放热,使热量的数值大于中和热,所以B项错;对于D选项,因为2 g H2相当于1 mol,故所写的热化学方程式中放出的热量应为571.6 kJ,故ΔH=-571.6 kJ/mol;由石墨比金刚石稳定可知石墨的能量应比金刚石低,则由金刚石转化成石墨应该放热,故本题的正确答案为C.
答案:C
5.(2009·天津理综高考)已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(g)+O2(g)
ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
( )
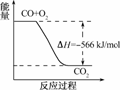
A.CO的燃烧热为283kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)
ΔH>-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
解析:A错,燃烧热的单位应是kJ/mol.B项,图中没有标注物质的系数.C项,由CO2(s)===CO2(g) ΔH>0及盖斯定律可知C项正确.D项,当反应放出509kJ热量时,参加反应的CO为1mol,电子转移数为2×6.02×1023.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com