
题目列表(包括答案和解析)
7.已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量.
4P(红,s)+5O2(g)===2P2O5(s) ΔH1
4P(白,s)+5O2(g)===2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是
( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
解析:据题意知1 mol白磷所具有的能量比1 mol红磷所具有的能量高,因此均为1 mol的白磷和红磷分别与5 mol O2完全反应生成1 mol P2O5固体时,白磷放出的热量更多,但ΔH为负值,故ΔH1>ΔH2,选B.
答案:B
6.2 mol NH3发生反应:2NH3N2+3H2,达到平衡时,测得混合
气体的物质的量为3.6 mol,反应吸收的热量为73.6 kJ,下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是
( )
A.3H2(g)+N2(g)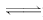
 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
B.3H2(g)+N2(g)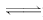
 2NH3(g) ΔH=-368 kJ/mol
2NH3(g) ΔH=-368 kJ/mol
C.3H2(g)+N2(g)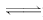
 2NH3(g) ΔH=-73.6 kJ/mol
2NH3(g) ΔH=-73.6 kJ/mol
D.3H2(g)+N2(g)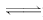
 2NH3(g) ΔH=+73.6 kJ/mol
2NH3(g) ΔH=+73.6 kJ/mol
解析:根据计算,达到平衡时NH3只有0.4 mol,即氨气分解了1.6 mol.当氨气分解了1.6 mol时,吸收73.6 kJ的热量.如果氨气分解了2 mol,则吸收92 kJ的热量.由此可以写出氢气与氮气反应生成氨气的热化学反应方程式.
答案:A
5.(2009·合肥高三质检)已知:
(1)Zn(s)+O2(g)===ZnO(s) ΔH=-348.3 kJ/mol
(2)2Ag(s)+O2(g)===Ag2O(s) ΔH=-31.0 kg/mol
则Zn与Ag2O 反应生成ZnO和Ag的热化学方程式为
( )
A.Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)
ΔH=317.3 kJ/mol
B.Zn+Ag2O===ZnO+2Ag ΔH=317.3 kJ/mol
C.Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)
ΔH=-317.3 kJ/mol
D.2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)
ΔH=-317.3 kJ/mol
解析:用(1)-(2)得:Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s) ΔH=-348.3 kJ/mol-(-31.0 kJ/mol)=-317.3 kJ/mol,故选C.
答案:C
4.使18 g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:
C(s)+O2(g)===CO(g) ΔH1=-Q1 kJ/mol
CO(g)+O2(g)===CO2(g) ΔH2=-Q2 kJ/mol
与完全燃烧相比较,损失的热量是
( )
A.1/2Q2 kJ B.1/3Q2 kJ
C.1/3(Q1+Q2) kJ D.1/3Q1 kJ
解析:n(C)==1.5 mol,与完全燃烧相比,损失的热量为CO(1.5mol×=0.5 mol)再完全燃烧所对应的热量,即0.5 mol×Q2 kJ/mol=0.5Q2 kJ,故选A.
答案:A
3.下列变化过程放热的是
( )
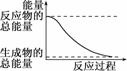
A.H2O(l)===H2O(g) ΔH=+44.0kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
解析:根据A、B中热化学方程式可知两反应均是吸热反应.本题易误选C,由于选项中未明确在化学反应中断开化学键时所吸收的能量大小,因此不能判断该反应的热效应.
答案:D
2.CH4的燃烧热为890 kJ/mol.下列热化学方程式正确的是
( )
A.CH4(g)+2O2(g)―→CO2(g)+2H2O(l)
ΔH=+890 kJ/mol
B.CH4+2O2―→CO2+2H2O ΔH=-890 kJ/mol
C.CH4(g)+2O2(g)―→CO2(g)+2H2O(l)
ΔH=-890 kJ/mol
D.CH4(g)+2O2(g)―→CO2(g)+2H2O(g)
ΔH=-890 kJ/mol
解析:燃烧放热,ΔH<0,A项错误;热化学方程式中要标明物质的状态,B项错误;据燃烧热的定义知产物水应为液态,故D错误,C正确.
答案:C
1.有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,使之能够实现,那么不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为
( )
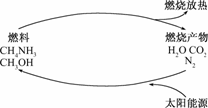
A.化学能 B.热能
C.生物能 D.电能
解析:根据图示及对光合作用的理解,太阳能量终转化为燃料燃烧所释放的热能,故选项B正确.
答案:B
22.(12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据).
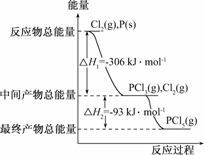
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
______________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
______________________________________;上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是__________________________;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一起反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”).
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________________.
解析:本题重点考查化学反应中的能量变化及化学平衡理论.(1)、(2)中ΔH=生成物的总能量-反应物的总能量,不难写出两个热化学方程式.分解率α1=×100%=25%;升温,化学平衡向吸热反应方向移动,因PCl5的分解要吸热,故升温,分解率增大,α2>α1.
(3)降温,化学平衡向放热反应方向移动.
(4)根据盖斯定律:一个化学反应不论是一步完成还是多步完成,其热效应总是相同的.
(5)PCl5和水的反应为水解反应.
答案:(1)Cl2(g)+P(s)===PCl3(g)
ΔH=-306 kJ/mol
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ/mol
25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ/mol 等于
(5)PCl5+4H2O===H3PO4+5HCl
21.(9分)《全球科技经济瞭望》报道了美国氢燃料电池技术的发展.科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量.
即:H2(g)+O2(g)===H2O(l) ΔH=-285.5 kJ/mol.
(1)试分析“氢能”将是未来21世纪最理想的新能源的原因
____________________;____________________(指出两个优点即可).
(2)目前世界上的氢气绝大部分是从石油、煤炭和天然气中制取.请写出工业上由天然气与H2O(g)反应制氢气的化学反应方程式____________________.
(3)利用硫-碘热循环法制取氢气也是化学家常用的一种方法,总反应方程式为2H2O2H2↑+O2↑,其循环过程分三步进行:
(a)SO2+I2+H2O―→A(________)+B(________)
(b)A(________)―→________+________
(c)B(________)―→________+________+________
完成以上三步反应,并确定最难进行的反应为________.
(4)目前,有人提出一种最经济最理想的获得氢能源的循环体系,如下图所示:
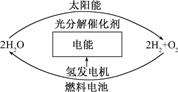
这是一种最理想的氢能源循环体系,类似于生物的光合作用,太阳能和水是用之不竭的,而且价格低廉.急需化学家研究的是______________________.
解析:(1)氢是宇宙中含量最丰富的元素之一,可提取出无穷无尽的氢气.氢气用作燃料不会污染环境,重量又轻,优点很多.
(2)该反应式的书写要注意工业上充分利用天然气,获得更多的氢气,必须利用廉价的水来提供氢,而不是直接分解.另外产物是二氧化碳,而不是一氧化碳,这样甲烷的利用率才更高.其反应式为CH4+2H2O(g)CO2+4H2.
(3)(a)SO2+I2+2H2O===2HI+H2SO4
(b)2HIH2+I2
(c)2H2SO4===2SO2↑+O2↑+2H2O
由于硫酸很稳定,所以反应(c)最难进行.
(4)由图可见,科学家需研究出合适的光分解催化剂,它能在光照下促使水的分解速率加快.
答案:(1)氢气来源广泛,作燃料不会产生污染等(答案合理即可)
(2)CH4+2H2O(g)CO2+4H2
(3)(a)SO2+I2+2H2O===2HI+H2SO4
(b)2HIH2+I2
(c)2H2SO4===2SO2↑+O2↑+2H2O
(4)合适的光分解催化剂,在光照下加快H2O的分解速率
20.(8分)写出下列热化学方程式:
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l);已知室温下2 g SiH4自燃放出热量89.2 kJ,其热化学方程式为
________________________________________________.
(2)0.3 mol气态高能燃料乙硼烷(B2H6),在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5 kJ热量,写出该反应的热化学方程式:
________________________________________.
(3)在101 kPa时,1.00 g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8 kJ的热量,C6H6的燃烧热为________ kJ/mol,该反应的热化学方程式为
__________________________________.
解析:(1)1 mol SiH4(g)自燃生成SiO2(s)和H2O(l)放出的热量为89.2 kJ×=1427.2 kJ,热化学方程式为:
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
ΔH=-1427.2 kJ/mol
(2) 1 mol B2H6(g)完全燃烧生成 B2O3(s)和H2O(l),放出的热量为=2165 kJ.热化学方程式为:
B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2165 kJ/mol
(3)1 mol C6H6(l)完全燃烧生成CO2(g)和H2O(l)放出的热量为 41.8 kJ×=3260.4 kJ,热化学方程式为:
C6H6(l)+O2(g)===6CO2(g)+3H2O(l)
ΔH=-3260.4 kJ/mol
答案:(1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
ΔH=-1427.2 kJ/mol
(2)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2165 kJ/mol
(3)3260.4
C6H6(l)+O2(g)===6CO2(g)+3H2O(l)
ΔH=-3260.4 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com