
题目列表(包括答案和解析)
3.电解CuCl2和NaOH的混合溶液,阴极和阳极上分别析出的物质是 ( )

答案: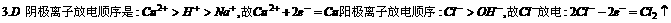
2.用石墨作电极,电解1mol几下列物质的溶液,溶液的pH保持不变的是 ( )
A.HCl RNaOH C.Na2 SO4 D.NaCl
答案:2.C 分析:A电解HCl(aq)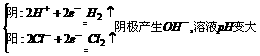
B.电解NaOH(aq) 相当于电解水,随溶液体积的减少,NaOH浓度增大,pH变大
C.电解Na2SO4亦相当于电解水,但Na2SO4浓度的增大,对溶液pH无影响
D.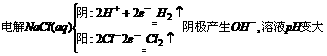
1.电解CuSO4溶液时,若要求达到以下三点要求:①阳极质量减少;②阴极质量增加;③电解液中c(Cu2+)不变,则可选用的电极是 ( )
A.含Zn、Ag的铜合金作阳极,纯铜作阴极
B.纯铜作阳极,含Zn、Ag的铜合金作阴极
C.用纯铁作阳极,用纯铜作阴极
D.用石墨作阳极,用惰性电极(Pt)作阴极
答案:1.B 分析:电解时阴极质量增加,则阴极Cu2+32+2+2+222454
2++-+2+223455672+2+2+2+2+2+2+2+2+6984142111111111212212121212121211212112121212121212121211212112111211-6986.2+放电,溶液中c(Cu2+)不变,故阳极有铜失去电子,Cu2+进入溶液
2.2,4,5-三氯苯酚和氯乙酸反应可制造除草剂2,4,5-三氯苯氧乙酸。某生产该除草剂的工厂曾在一次事故中泄漏出一种有毒的二 英,简称TCDD,有关物质的结构如下:
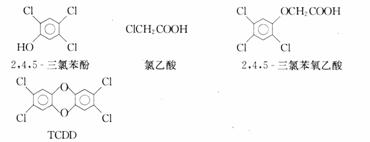 请写出:(1)生成2,4,5-三氯苯氧乙酸反应的化学方程式,
请写出:(1)生成2,4,5-三氯苯氧乙酸反应的化学方程式,
(2)由2,4,5-三氯苯酚生成TCDD反应的化学方程式。
1.有一种工业废水,已知其中含少量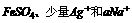 ,以及部分污泥,试设计一个既经济又合理的方法回收金属银和FeSO4,分别列出实验步骤,并说明每一步骤的目的。
,以及部分污泥,试设计一个既经济又合理的方法回收金属银和FeSO4,分别列出实验步骤,并说明每一步骤的目的。
答案: 1.(1)过滤除去污泥;(2)滤液加入适量Fe粉,使Ag还原成Ag;(3)过滤,使Ag和过量Fe从溶液中分离出来;(4)将混有铁粉的银用稀H2SO4处理,使Fe溶解;(5)过滤,分离出银: (6)将(3)和(5)步滤液合并蒸发浓缩、冷却,使FeSO4结晶析出;(7)过滤得到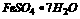 晶体
晶体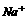 留在母液中
留在母液中
16.以银为原料制备AgNO3的过程是:银和浓度为50%-60%的HNO3作用,反应放热,待反应平稳后适当加热后冷却得AgNO3晶体。
(1)分别写出银与浓HNO3、稀HNO3反应的方程式。
(2)从反应方程式看用浓HNO3和稀HNO3与银作用,哪种硝酸利用率高?为什么生产上用浓度
为50%-60%的硝酸(较浓)?
(3)工厂生产时使Ag或HNO3哪种过量更易控制?简述原因。
答案: 16.(1)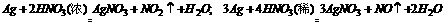
(2)稀HNO3高,但太稀的HNO3与银反应速率太慢
(3)银过量更容易控制。因为当其充分反应后银仍有剩余可过滤回收
综合能力训练
15.某同学在CuSO4溶液中加入过量NaOH溶液和适量HNO3,制得纯净的Cu(NO3)溶液。
(1)NaOH溶液为什么要过量?
(2)怎样检验NaOH溶液已过量?
(3)在制备过程中,该生必须采取什么操作步骤才能得到纯净的Cu(NO3)2?
答案:15.(1)为使完全成为 Cu(OH)2 (2)取上层澄清液再加人一滴NaOH溶液无沉淀生成(3)过滤,同时洗涤沉淀,然后将沉淀溶于适量的HNO3 ,即制得纯净的Cu(NO3)2 溶液
14.实验室制备硝基苯的主要步骤如下:①配制一定比例的浓硫酸和浓硝酸的混合液,加入反应器中;②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;③在50℃-60℃下发生反应.直至反应结束;④除去混合酸后,粗产品依次用蒸馏水和5%氢氧化钠溶液洗涤,最后再用蒸馏水洗涤;⑤将用无水氯化钙干燥的硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合液,操作注意事项是:
(2)步骤③中,为了使反应在50℃ -60℃下进行,常用的方法是: .
(3)步骤④中,洗涤、分离粗硝基苯应使用的仪器是: .
(4)步骤④中,粗产品用5%氢氧化钠溶液洗涤的目的是: 。
(5)纯硝基苯五色,密度比水 ,是具有 气味的液体。
答案:14.(1)浓硫酸沿器壁慢慢加入HN03中,并不断搅拌
(2)水浴加热
(3)分液漏斗
(4)除去H2SO4和HNO3
(5)大,苦杏仁
13.某课外活动小组欲利用右图装置和下列试剂制取少量气体
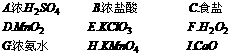
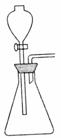
试用各试剂序号回答:
(1)若要快速制取少量O2,应选择 。
(2)若要快速制备少量HCl,应选择 。
(3)若要快速制取少量NH3,应选择 。
答案: 13.(1)D、F 因为 (2)A、B 因为H2SO4(浓)具有吸水性,吸收浓盐酸中的水更易挥发出HCl气体
(3)G、I
因为
(2)A、B 因为H2SO4(浓)具有吸水性,吸收浓盐酸中的水更易挥发出HCl气体
(3)G、I
因为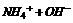 ⇌
⇌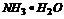 ⇌
⇌ 结合水使浓氨水更易挥发,CaO结合水生成Ca(OH)2,OH-浓度变大更易生成NH3
结合水使浓氨水更易挥发,CaO结合水生成Ca(OH)2,OH-浓度变大更易生成NH3
12.实验室制备气体时选择反应发生装置的原则是 ( )
A.所制气体的密度 B.所制气体的水溶液 C.反应物的状态 D.发生反应的条件
答案:12.CD 因为制备气体选择反应发生装置时主要考虑反应物的状态和发生反应所需要的条件
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com