
题目列表(包括答案和解析)
5.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外
层电子数的2倍。下列说法中,正确的是 ( )
A.离子半径:Y>X B.气态氢化物的稳定性:Z>X
C.Y的氧化物中含有离子键 D.Z的氧化物对应的水化物是弱碱
解析:由Y、Z元素的位置和原子结构,推测X只能是第二周期元素且Z是C元素
或Si元素,Y是Be元素或Mg元素,采用假设法,推断X元素是N元素、Y是Mg
元素、Z是Si元素。A项,Mg2+半径比N3-小;B项,NH3比SiH4稳定;C项,MgO
中含有离子键,正确;D项,SiO2→H4SiO4或H2SiO3,H4SiO4或H2SiO3是一种弱酸。
答案:C
4.(2010×模拟题)下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③酸性:H3PO4>H2SO4>HClO4
④结合H+能力:OH->CH3COO->Cl-
A.①③ B.②③ C.①④ D.②④
解析:①中应是HF>H2O>H2S;②正确;③中应是HClO4>H2SO4>H3PO4;④正确。
答案:D
3.(2010×模拟题)根据相关原理判断,下列各元素中一定属于主族元素的是( )
A.X元素能形成+7价的含氧酸及其盐
B.Y元素的原子最外电子层上有2个电子
C.Z元素的阴离子与同一周期稀有气体元素原子的电子层结构相同
D.R元素的最高价氧化物的水化物呈酸性
解析:A项,KMnO7中Mn呈+7价,但Mn是ⅦB族元素;B项,过渡金属元素的
许多原子最外层上有2个电子,He原子最外层上也有2个电子;C项,Z元素有阴
离子,一定属于非金属元素,非金属元素一定属于主族元素;D项,部分过渡金属元
素最高价氧化物的水化物呈酸性,如Mn2O7→HMnO4、CrO3→H2CrO4等。
答案:C
2.(2010×原创题)X、Y、Z和W代表原子序数依次增加的四种短周期元素,在周期表中,
Z与Y相邻,Z与W也相邻,Y、Z和W三种元素的原子最外层电子数之和为17,
X能分别与Y、Z形成电子总数相等的分子A、B。下列有关判断不正确的是( )
A.Y与W的非金属性均比磷元素强
B.原子半径由大到小的顺序为:W>Z>Y
C.化合物B中含有的化学键均为非极性共价键
D.X的单质是一种有广阔应用前景的新能源
解析:根据题干条件,可划出它们的相对位置关系是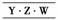 或
或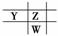 ,再结合
,再结合
Y、Z和W最外层电子数为17,显然Y为N、Z为O、W为S;X为H元素。可见
C项符合题意。
答案:C
1.(2010×改编题)短周期元素A、B、C的位置如右图所示,已知B、C两元素所在族序
数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,
则A、B、C依次是 ( )
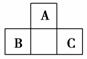
A.Be、Na、Al B.N、Si、S C.O、P、Cl D.C、Si、P
解析:由A、B、C的相对位置,可判断A为第二周期元素,B、C均为第三周期元
素,设A的原子序数为a,那么,B和C的原子序数分别为(a+8-1)、(a+8+1),再根
据A、B、C在原子序数之间的关系可列出4a=a+8-1+a+8+1=2a+16,∴a=8,那么A
为O、B为P、C为Cl。
答案:C
15.(重庆高考)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反
应式为:Pb+PbO2+4H++2SO42-放电充电2PbSO4+2H2O
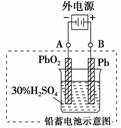
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是____________________________;电解液中
H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增
加__________g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极
上生成_______、B电极上生成_______,此时铅蓄电池的正负极的极性将_______。
解析:回答本题的关键在于抓住电池总反应式中各反应物和生成物之间质和量的
关系。(1)放电时正极上发生还原反应,并消耗H2SO4,生成PbSO4沉淀。(2)当完
全放电耗尽PbO2和Pb时,按图连接,进行电解时,A极是电解池的阴极,B极
是电解池的阳极。
答案:(1)PbO2+2e-+4H++SO42-===PbSO4+2H2O 小 48
(2)Pb PbO2 对换
14.(2010·江苏如皋高三期末)金属镁在目前的汽车、航天、航空、机械制造、军事等
产业中得到迅猛发展。
(1)目前市场上某些品牌笔记本电脑(如神舟电脑、IBM电脑等)的外壳一改以往的有
机合成材料,而使用镁铝合金、钛铝合金等材料。镁铝合金材料在电脑上代替有机
合成材料的目的是________。(多选)
A.降低成本 B.增强美观 C.利于散热
D.增加强度 E.增加运算速度
(2)某学校研究性学习小组欲以镁条、铝片为电极,以稀NaOH溶液为电解质溶液
设计原电池。
①给你一只安培表,请你画出该原电池的示意图,并标出正负极。
②一段时间后,铝片发生的电极反应式是___________________________________;
镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-===H2↑+2OH-,则镁电
极产生的主要反应的电极反应式为______________。
解析:(1)铝合金材料比有机合成材料在价格上要高,所以A错;实际上铝合金材料
在电脑外壳上的使用是从“增加强度”和“增强美观”的角度考虑的,当然铝合金
作为电脑的外壳材料散热效果要比有机合成材料好的多;铝合金材料的应用与电脑
的运算速度没有关系。
(2)铝能够与NaOH溶液反应,所以作为原电池的负极,而镁则作为正极。

 答案:(1)BCD (2)①如图所示 ②Al+4OH- AlO2-+2H2O+3e-
答案:(1)BCD (2)①如图所示 ②Al+4OH- AlO2-+2H2O+3e-
 O2+2H2O+4e-
4OH-
O2+2H2O+4e-
4OH-
13.新型高能钠?硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电
池放电时为原电池,充电时为电解池,反应原理为:2Na+xS放电充电Na2Sx。
(1)放电时Na发生________反应,S作________极。
(2)充电时Na所在电极与直流电源的________极相连。
(3)放电时负极反应为___________________________________________________;
充电时阳极反应为______________________________________________________。
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,
消耗金属Na的质量为________。
解析:该题考查化学“两池”(原电池、电解池)的原理及应用,以新的科技成果
即新型高能钠?硫电池为背景,要求考生学会应用原电池的原理解释新问题、新
现象。主要考查对知识的应用能力 、计算能力、推理能力等。
解答本题要仔细审题,寻找突破口--“电池放电时为原电池”,根据原电池的
知识,失电子,发生氧化反应的电极是负极;得电子,发生还原反应的电极是正
极。(1)Na作负极,S作正极。负极反应为Na-e-===Na+;(2)“充电时为电解
池”,根据电解的知识,阳极失电子,发生氧化反应;阴极得电子,发生还原反
应。因此Na所在的电极是阴极,与直流电源的负极相连,S所在的电极是阳极,
与直流电源的正极相连,阳极反应式为Sx2--2e-===xS。(4)电解饱和NaCl溶液阳
极产生的气体是Cl2,由2Cl--2e-===Cl2,又2Na-2e-===2Na+,可列式求得Na
的质量为69克。
答案:(1)氧化 正 (2)负

 (3)Na-e- Na+ Sx2--2e- xS (4)69 g
(3)Na-e- Na+ Sx2--2e- xS (4)69 g
12.有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的
能源,它依靠人体内体液中含有一定浓度的溶解氧、H+和Zn2+进行工作,试分析
其工作原理,并写出有关反应的化学方程式。
解析:根据构成原电池的三个条件分析:Zn是较活泼金属,与Pt组成了原电池的
电极。体液中O2在Pt电极上发生反应;依靠体液作电解质溶液。
答案:(1)相互连接的Pt和Zn作原电池的电极。
(2)溶有O2、H+和Zn2+的人体体液作为电解质溶液。因Zn活泼性大于Pt,故Zn
 是原电池的负极:Zn-2e- Zn2+;Pt作为原电池的正极,由于人体体液不可能
是原电池的负极:Zn-2e- Zn2+;Pt作为原电池的正极,由于人体体液不可能
呈强酸性,故正极反应类似吸氧腐蚀:O2+2H2O+4e-===4OH-,总反应化学方
 程式是:2Zn+O4e-2+2H2O 2Zn(OH)2
程式是:2Zn+O4e-2+2H2O 2Zn(OH)2
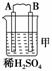
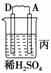
11.由A、B、C、D四种金属按下表中装置进行实验。
|
装置 |
 |
 |
 |
|
现象 |
二价金属A 不断溶解 |
C的质量 增加 |
A上有气 体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_________________________________________。
(2)装置乙中正极的电极反应式是_________________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_____________________________________。
解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为
负极、B为正极,活泼性A>B;乙中C极增重,即析出Cu,则B为负极,活泼性
B>C;丙中A上有气体即H2产生,则A为正极,活泼性D>A,随着H+的消耗,pH
变大。

 答案:(1)A-2e-
A2+ (2)Cu2++2e-
Cu (3)变大 (4)D>A>B>C
答案:(1)A-2e-
A2+ (2)Cu2++2e-
Cu (3)变大 (4)D>A>B>C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com