
题目列表(包括答案和解析)
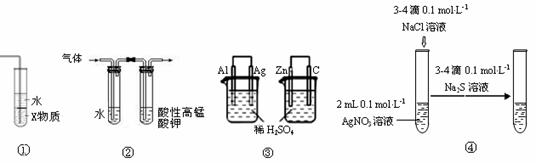
9、(2011延庆11.)关于图中各装置的叙述不正确的是
A.装置①中X若为四氯化碳,可用于吸收氨气,并防止倒吸
B.装置②可检验溴乙烷发生消去反应得到的气体中含有乙烯
C.装置③的两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
8、(2011延庆10.)下列实验或图表的结论或解释正确的是
|
|
实验或图表 |
结论或解释 |
|
A |
铝 箔在酒精灯火焰上加热熔化但不滴落 箔在酒精灯火焰上加热熔化但不滴落 |
铝箔表面生成的氧化物具有高熔点 |
|
B |
某CH3COOH和CH3COONa组成的酸性溶液中,加入一定量氨水 |
c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
|
C |
 |
该反应热化学方程式为 2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ/mol |
|
D |
铁制容器可用于盛装冷的浓硫酸 |
铁与浓硫酸不反应 |
7、(2011石景山-12.关于下列各图的叙述,正确的是 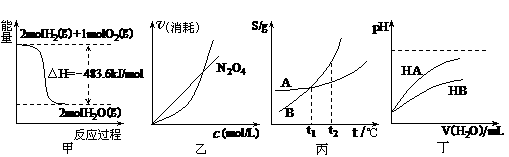
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温
至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
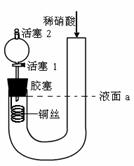
6、(2011丰台9)为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
A.关闭活塞1,加入稀硝酸至液面a处
B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO
5.(门头沟区9)关于下列各装置图的叙述中,正确的是
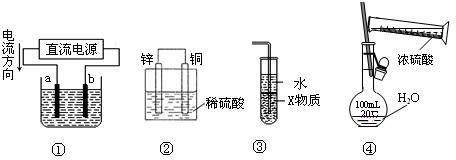
A.若采用装置①精炼铜,则a极为纯铜, b极为粗铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸
 D.装置④可用于实验室配置一定物质的量浓度的稀硫酸
D.装置④可用于实验室配置一定物质的量浓度的稀硫酸
4、(2011东城区12.)关于图-7中四个图像的说法正确的是
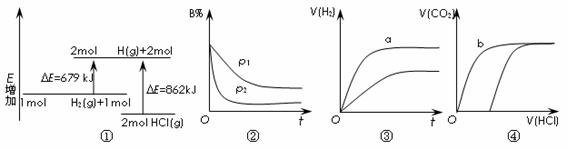
注:图-7中,E表示能量, p表示压强,t表示时间,V表示体积,B%表示B的体积百分含量。
A.①表示化学反应H2(g) +Cl2(g) =2HCl(g)的能量变化,则该反应的反应热DH =183 kJ/mol
B.②表示其它条件不变时,反应 4A(g) +3B(g) 2C(g)+6D在不同压强下 B% 随时间的变化,则D一定是气体
2C(g)+6D在不同压强下 B% 随时间的变化,则D一定是气体
C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D.④表示10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L HCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
3、(2011东城区11)下表中所示物质或概念间的从属关系符合图-6的是
|
|
X |
Y |
Z |
|
A |
钠元素 |
主族元素 |
短周期元素 |
|
B |
氢氧化铁 |
胶体 |
分散系 |
|
C |
电解质 |
化合物 |
纯净物 |
|
D |
置换反应 |
氧化还原反应 |
放热反应 |
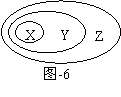
2、(2011海淀1模12.)相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)
+ 3H2(g)
 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
|
容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
放出热量a kJ |
|
② |
2 |
3 |
0 |
放出热量b kJ |
|
③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
1、(2011海淀1模11.)下列实验设计能够成功的是
|
|
实验目的 |
实验操作 |
|
A |
实验室制备硝基苯 |
将苯和浓硝酸混合后加热 |
|
B |
除去硫酸钠溶液中少量氯化钠杂质 |
向含有氯化钠杂质的硫酸钠溶液中加入适量的硝酸银溶液,过滤 |
|
C |
检验溴乙烷发生消去反应的产物 |
向盛有少量溴乙烷的试管中,先加入氢氧化钠溶液,再滴入用硝酸酸化的硝酸银溶液 |
|
D |
浓硝酸的氧化性强于稀硝酸 |
向盛有少量的浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片 |
15.以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯被授予2004年诺贝尔化学奖,以表彰他们发现了泛素调节的蛋白质降解。蛋白质是由氨基酸组成的,一定条件下蛋白质或多肽可以水解,最终产物为氨基酸。今有1个多肽,其化学式为C32H44N6O7,已知它在一定条件下彻底水解只得到下列三种氨基酸:
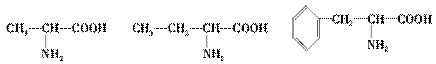
(1)这个多肽是________肽。
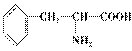 (2)1 mol该多肽彻底水解生成
(2)1 mol该多肽彻底水解生成
的物质的量为________mol。
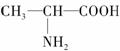 (3)已知
(丙氨酸)在水溶液中存在如下关系:
(3)已知
(丙氨酸)在水溶液中存在如下关系:
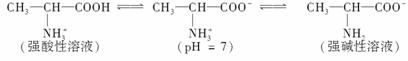
现以Pt电极在下列介质中电解丙氨酸溶液,
①在强酸性溶液中,在________极析出丙氨酸。
②在强碱性溶液中,在________极析出丙氨酸。
③在pH=7时,阴极上的电极反应为________________________________________。
解析:(1)有n个氨基酸就是n肽,故解题的关键就是要计算氨基酸的个数。从给定的氨基酸分子来看,每个氨基酸只提供1个N原子,由多肽分子中的N原子数可确定肽的数目是6。
(2)生成5分子水,则原6个氨基酸分子中C、H、O、N原子的总数依次为32、54、12、6,设这三种氨基酸的个数依次为x、y、z,根据C、H、O、N的原子守恒,可求出x=y=z=2。
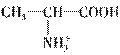 (3)在强酸性溶液中,丙氨酸以
(3)在强酸性溶液中,丙氨酸以
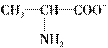 形式存在,故以Pt为电极电解时丙氨酸向阴极移动,且在阴极析出;在强碱性溶液中,丙氨酸以
形式存在,故以Pt为电极电解时丙氨酸向阴极移动,且在阴极析出;在强碱性溶液中,丙氨酸以
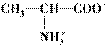 形式存在,故以Pt为电极电解时,丙氨酸向阳极移动,且在阳极析出;当pH=7时,丙氨酸以
形式存在,故以Pt为电极电解时,丙氨酸向阳极移动,且在阳极析出;当pH=7时,丙氨酸以
(中性离子)的形式存在,以Pt为电极电解时丙氨酸既不向阳极移动,也不向阴极移动,此时实际上是电解水,故阴极反应为:2H++2e-===H2↑。
答案:(1)6 (2)2
(3)①阴 ②阳 ③2H++2e-===H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com