
题目列表(包括答案和解析)
5.53mol/L
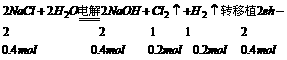
即电解的m(NaCl)=0.4mol×58.5g/mol=23.4g
电解后m(NaOH)=0.4mol
设:原NaCl的饱和溶液为xg,那么有:
136:36=x:23.4 x=88.4g
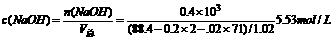
35.将20℃时的饱和食盐水进行电解(20℃时NaCI溶解度为36 g)。当有0.4 mol电子发生转移时,NaCl电解完全,测得电解后溶液的密度为1.02g/cm3,求电解后溶液的物质的量浓度。
答案:
34.为了充分利用原料降低成本,现有70%的H2SO4溶液35g,含杂质为20%的烧碱25g(假设杂质不参与任何化学反应)和足量的铝屑,求最多可制得氢氧化铝多少克?
答案:
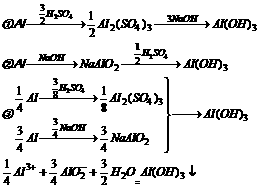
经分析可知:第③种途径成本最低,原料利用率最高,用70%的H2SO435g与20%杂质的NaOH25g恰好全部反应,生成Al(OH)3
m[Al(OH)3]=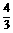 ×0.5mol×78=52g
×0.5mol×78=52g
33.有一白色固体,可能是由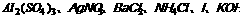 、Na2S中的两种或三种组成,为确定该白色固体的组成,进行下列实验:①取白色固体少许,加入蒸馏水充分振荡,得到无色溶液;②取少量五色溶液,逐滴加入HNO3,有白色沉淀生成。试回答:
、Na2S中的两种或三种组成,为确定该白色固体的组成,进行下列实验:①取白色固体少许,加入蒸馏水充分振荡,得到无色溶液;②取少量五色溶液,逐滴加入HNO3,有白色沉淀生成。试回答:
(1)此白色固体中至少存在哪几种物质?请写出全部可能情况:(可不填写,也可补充)
第一种情况 ;
第二种情况 ;
第三种情况 ;
第四种情况 .
(2)若要证明固体的组成,还需要做的实验: .
答案:(1)Al2(SO4)3、NH4Cl、NH4KOH AgNO3
(2)分别滴入过量的稀硝酸,产生白色沉淀的是NH4Cl、KOH、AgNO3一组;不产生沉淀的则是Al2(SO4)3、KOH一组。
32.甲、乙、丙、丁、戊分别是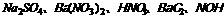 五种溶液中的一种,现利用某X溶液鉴别它们,根据下图关系回答问题:
五种溶液中的一种,现利用某X溶液鉴别它们,根据下图关系回答问题:
(1)写出下列物质的化学式:
甲 乙 丙 丁 戊 X
(2)写出下列反应的离子方程式:
①X+甲 ;
②A+乙 ;
③Y+戊 .
答案:
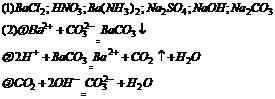
向五种物质中加X有白色沉淀,只可能为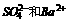 引起,加乙有气体不可能
引起,加乙有气体不可能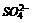 ,引起白色沉淀,即推X为Na2CO3
,引起白色沉淀,即推X为Na2CO3
31.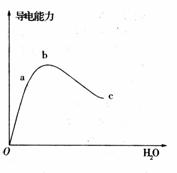 把河沙(主要成分是SlQ)跟镁粉按一定质量比(大约为15:24)
把河沙(主要成分是SlQ)跟镁粉按一定质量比(大约为15:24)
混合均匀,装入试管中,加热约1分钟后发生剧烈反应,生成一种白色固体和一种硅化物。将生成的混合物冷却后放人盛有稀硫酸的烧杯中,立即产生气泡和轻微爆炸声,这是因为生成的气体在空气中能自燃。
(1)写出河沙与镁粉反应的化学方程式 。该反应是 热反应(填“放”或“吸”)。
(2)生成的混合物放人稀硫酸,产生气体的离子方程式 .
(3)气体在空气中产生“爆炸声”化学方程式 .
答案:
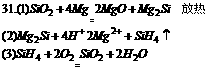
30.在一定的温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:
(1)“O”点导电能力为零的理由: 。
(2)a、b、c三点溶液pH由小到大的顺序为 。
(3)a、b、c三点电离度最大的是 。
(4)若使c点溶液的c(Ac-)增大,溶液的pH也增大,可采取的措施是:① , ② ,③ 。
答案:30.(1)冰醋酸未电离(无离子) (2)b<a<c (3)c (4)加固体NaOH,加固体NaAc,加知活泼金属M g、Zn等。
29.我国首创的以铝-空气-海水电池为能源的新型海水标志灯,利用空气中的氧使铝不断氧化,海水为电解质溶液而产生电流。这种电池以 为负极,电极反应式 .
答案:29.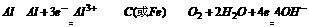
28.三氧化二砷(As2O3)俗称砒霜,是人们熟悉的剧毒物质。法医和环保部门为鉴定试样中是否含砒霜,通常用马氏试砷法。此法是把试样与稀硫酸、锌混合,将产生的气态砷化氢,导人一特制玻璃管,隔绝空气加热,砷化氢受热分解,析出亮黑色的砷单质,附着在玻璃管上,形成“砷镜”,这种“砷镜”能溶于NaCl0溶液,生成砷酸,有别于“锑镜”。试回答:
(1)写出As原子的结构示意简图 ,砷最高价氧化物的化学式为 ;
(2)写出砒霜与稀硫酸、锌混合反应的化学方程式 。
(3)写出“砷镜”被NaCIO溶液溶解的离子反应方程式 。
答案:(1)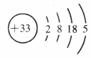 As2O5
As2O5
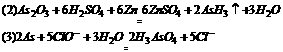
27.在硫酸工业生产中,为了防止污染,保护环境,尾气可用 吸收,然后再用 处理,这样得到的气体中SO2的含量较高,可返回车间再用。写出有关反应的方程式 .
答案:氨水;硫酸;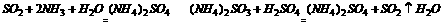
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com