
题目列表(包括答案和解析)
1.下图显示了经济发展与环境质量的关系,根据这种关系,发展中国家应采取的策略是 ( )
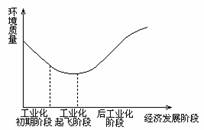
A.环境污染不可避免,只能采取先污染,后治理的策略
B.后工业化阶段环境问题会自然解决
C.保护环境至关重要,必须杜绝兴建大量排污的工业
D.可采取措施减少或避免发展过程中的环境污染
12.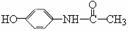 (15分)目前市场上售卖的白加黑、帕尔克、泰诺感冒片、感冒灵、去痛片等均含扑热息痛对乙酰氨基酚 ,其合成路线如下图所示。
(15分)目前市场上售卖的白加黑、帕尔克、泰诺感冒片、感冒灵、去痛片等均含扑热息痛对乙酰氨基酚 ,其合成路线如下图所示。
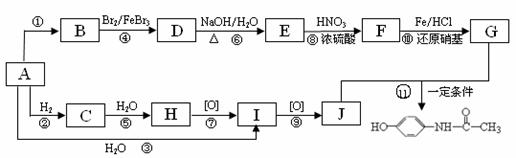
已知:A是相对分子质量最小的不饱和烃;B是由12个原子构成的平面分子;MB=3MA;G中含有两种官能团,其中一种为-NH2。
回答下列问题:
(1)B的结构简式是 ;I中官能团的名称是 。
(2)反应①-11中属于加成反应的有 ;属于取代反应的有 。(各任写2个)
(3)H与J在浓硫酸作用下合成W(C4H8O2),写出与W同类的有机物的所有同分异构体的结构简式(不包含W) 。
(4)写出J与G反应生成对乙酰氨基酚的化学方程式 。
(5)设计方案说明苯酚、H2CO3、J的酸性依次增强(用化学方程式表示) 。
11.(15分)
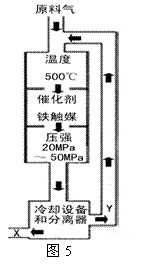
(1)工业合成氨的原理可表示为:
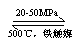
N2+3H2 2NH3 ;△H<0。
生产流程如图5所示。
①图5中X的化学式是 。
②图5中条件选定的主要原因是 。(选填字母序号)
A.升高温度、增大压强均有利于提高氨的转化率
B.铁触媒在该温度时活性大
C.工业生产需综合考虑动力、材料和设备等因素
(2)图6是T1℃时容器中NH3的物质的量随时间的变化曲线。
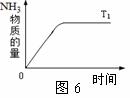 请在图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线。
请在图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线。
(3)一定温度下,在密闭容器中充入1 mol N2和3 mol H2使其
充分反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,
则N2的转化率а1= 。
 ②若容器压强恒定,达到平衡时,容器中N2的转化率为а2,
②若容器压强恒定,达到平衡时,容器中N2的转化率为а2,
则а2 а1。(选填“>、<或=”)
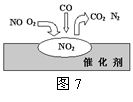
(4)汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的
过程如图7所示,由此判断,汽车尾气的主要污染成分是 。
10.(15分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;
c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。 理由是 。(3)由③可证明 离子存在。写出a、b、c、d所涉及的化学方程式,是离子反应的用离子方程式表示 。
 (4)由④可以排除
离子存在,同时证明 离子的存在。
(4)由④可以排除
离子存在,同时证明 离子的存在。
9. (15分)
(15分)
Ⅰ 有A、B、D、N、E五种短周期元素,原子序数依次增大。A元素
的单质是自然界最轻的气体,同周期元素中N元素的原子半径最大。
B、D、E在周期表的位置如图2所示。它们的原子序数之和为31。
试回答:
(1)A、D、E、N形成的简单离子的半径由大到小的关系是 。(用离子符号表示)
 (2)写出化合物N2D的电子式
。
(2)写出化合物N2D的电子式
。
(3)NH3•H2O的电离方程式是NH3•H2O NH4++OH-。试判断NH3溶于水后形成的NH3•H2O的合理结构 。(选填“a”或“b”)
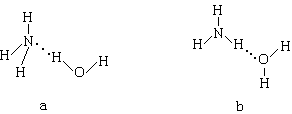
 Ⅱ 乙二酸H2C2O4俗称草酸,常见的草酸是含有两分子结晶水的无色晶体。草酸易溶于水,是二元弱酸,酸性强于碳酸,其所形成的草酸钙和草酸氢钙是白色不溶于水的物质。草酸晶体的熔点为101.5℃,在157℃升华。草酸分解的化学方程式是
Ⅱ 乙二酸H2C2O4俗称草酸,常见的草酸是含有两分子结晶水的无色晶体。草酸易溶于水,是二元弱酸,酸性强于碳酸,其所形成的草酸钙和草酸氢钙是白色不溶于水的物质。草酸晶体的熔点为101.5℃,在157℃升华。草酸分解的化学方程式是
H2C2O4 H2O↑+CO2↑+CO↑
设计下图装置验证草酸分解产物中有CO2。
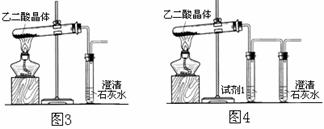
(1)装置图中试管口向上倾斜的原因是 。
(2)经长时间加热后,装置图3试管里的石灰水只变浑浊不变澄清的原因是 。
(3)装置图4中的试剂1应是 。
A.NaOH B.NaHCO3 C.冷水
(4)指出装置图4存在的不足 。
8.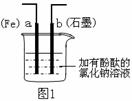 图1所示装置可组装成原电池或电解池。下列说法不正确的是 ( )
图1所示装置可组装成原电池或电解池。下列说法不正确的是 ( )
A.若是原电池,电子由a极流出
B.a电极上可能发生反应2Cl--2e-=Cl2↑
C.组装后的装置可用于制备氢氧化亚铁或氢氧化钠
D.若b作阳极,通电后,a电极附近呈红色
7.下列关于热化学反应的描述正确的是 ( )
A.酸跟碱发生中和反应生成1 mol水的反应热叫做中和热
B.在101 kPa时,1 mol葡萄糖燃烧生成6molCO2(g)和6molH2O(g)所放出的热量就是葡萄糖的燃烧热
C.已知:S(g)+O2(g)=SO2(g);△H=-297.3kJ/mol,则1molSO2的键能总和大于1molS和1molO2键能之和
D.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8 kJ/mol 、1411.0 kJ/mol 和1366.8 kJ/mol,则完全燃烧等质量的上述3种物质,C2H4(g)放出的热量最多
6.能正确表示下列化学反应的离子方程式是 ( )
A.少量金属钠投入水中2Na+H2O=2Na++2OH-+H2↑
B.少量CO2气体通入Ca (ClO)2溶液中CO2+2ClO-+H2O = CO32-+2HClO
C.amolSO2通入2amolNa2CO3溶液中CO32-+SO2+H2O=HCO3-+HSO3-
D.在KHSO4溶液中加入Ba(OH)2溶液至中性2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
5.下列说法正确的是 ( )
A.0.2mol/L氨水中,c(OH-) = c(NH4+)
B.0.2 mol/L醋酸与0.1 mol/L醋酸中c(H+)之比为2:1
C.0.2mol/L AlCl3溶液中c(Al3+)与c(Cl-)之比为3:1
D.10 mL 0.2mol/L硫酸与10 mL 0.2mol/LNaOH混合后溶液的pH=1(混合后溶液的体积以20 mL计)
4. 下列说法正确的是
下列说法正确的是
A.在ⅣA元素所形成的氢化物中,甲烷的热稳定性最高
B.同一周期中,ⅠA族单质的熔点比ⅡA族的高
C.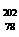 Pt和
Pt和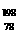 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
D.0族元素性质不活泼,是因为各元素原子的最外层电子数均为8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com