
题目列表(包括答案和解析)
17. 有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:________________(用化学式表示)。

a
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元素组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。如图所示转化关系,推测:戊可能为:________________、________________(列举合适的两例)。
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的原电池反应,则负极发生的电极反应式为:_____________________________________________________________。
b
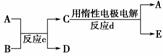
(3)若右图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物。已知:A是常见的金属单质,反应c为置换反应。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:__________________________________________________________。
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物时,则反应c的化学方程式为:______________________________________。
解析:因②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,结合其在元素周期表中的相对位置可以推出②为碳,⑦为硫,⑧为氯;其最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;(2)因反应a为置换反应,所以甲、乙、丙、丁四种物质中有两种是单质,两种是化合物,设甲为氧气,乙可能是氨气或硫化氢或甲烷等气态烃,丙则可能为氮气、硫或C,丁为水,戊为NO或SO2或CO、CO2等;若甲为CO2,则乙可能为Mg,丙可能为C,丁可能为MgO,戊可能为CO;若甲是O2、乙是N2H4,则在强碱性溶液中进行的反应a的原电池反应的负极反应式为N2H4+4OH--4e-―→N2+4H2O。(3)若反应c是用A作电极,在B的水溶液中进行电解反应的置换反应,结合反应d的生成物,可以确定A可能为铜等活动性相对较弱的金属,B的水溶液可能为硫酸、盐酸等酸溶液,C为可溶性铜盐或相应金属的盐溶液,D为氢气;若A为铜时,则反应d中阴极的电极反应式为Cu2++2e-―→Cu;若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,可联想到铝热反应,其常见的化学方程式为Fe2O3+2Al2Fe+Al2O3。
答案:(1)HClO4、H2SO4、H2CO3 (2)CO、SO2、NO(任举两例,其他合理答案也可) N2H4+4OH--4e-―→N2+4H2O (3)Cu2++2e-―→Cu(或Zn2++2e-―→Zn、Ni2++
2e-―→Ni);Fe2O3+2Al2Fe+Al2O3
16.X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如右图所示的变化:

已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在元素周期表中的位置是________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入________(填物质名称);负极电极反应式为________________________。
(3)C在一定条件下反应生成A的化学方程式是________________。
(4)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液的pH________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示):________________。
(5)已知Y的单质与Z的单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
解析:除惰性气体外,短周期的无色气体只有H2、N2、O2,由此不难确定X为O,Y为N,Z为H。
(5)设反应开始一段时间后生成NH3 x mol。
N2 + 3H22NH3
反应前 a mol a mol 0
反应后 a- a-x x
则反应后N2的体积分数为=50%。
答案:(1)第二周期ⅣA族 (2)氧气 H2+2OH--2e-―→2H2O (3)4NH3+5O2高温催化剂4NO+6H2O (4)小于 NH+H2O NH3·H2O+H+ (5)ab
NH3·H2O+H+ (5)ab
15. 不同的金属在化学反应中表现出来的活泼程度不同,早在1812年瑞典化学家贝采里乌斯根据大量实验现象首先提出了金属活动顺序的概念,后来俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是________、________。
工业上又常用下列反应进行金属钾的冶炼:Na+KClK↑+NaCl,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因________________________________________________________________________。
(2)在实践中发现还有许多化学事实“违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1 mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释________________、________________。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱________。
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
方案:___________________________________________________________________。
解析:(1)可以用“热分解法”冶炼的金属是不活泼的金属(铂、金通常以单质形式存在于自然界中),如银、汞等;反应Na+KCl K↑+NaCl之所以能进行是因钾以蒸气形式逸出后,促使平衡不断右移的结果。(2)在FeCl3溶液中, 因存在Fe3+的水解,所以呈酸性;锌粒表面产生气泡是锌与溶液中的H+反应的结果,溶液颜色变浅是锌与Fe3+反应的结果;溶液出现浑浊是Fe3+水解程度增大,生成Fe(OH)3沉淀的结果;(3)由氯化铁溶液腐蚀铜制电路板的反应2Fe3++Cu===2Fe2++Cu2+,可知Fe3+的氧化性大于Cu2+;由湿法炼铜Fe+Cu2+===Fe2++Cu可知,Cu2+的氧化性大于Fe2+。
K↑+NaCl之所以能进行是因钾以蒸气形式逸出后,促使平衡不断右移的结果。(2)在FeCl3溶液中, 因存在Fe3+的水解,所以呈酸性;锌粒表面产生气泡是锌与溶液中的H+反应的结果,溶液颜色变浅是锌与Fe3+反应的结果;溶液出现浑浊是Fe3+水解程度增大,生成Fe(OH)3沉淀的结果;(3)由氯化铁溶液腐蚀铜制电路板的反应2Fe3++Cu===2Fe2++Cu2+,可知Fe3+的氧化性大于Cu2+;由湿法炼铜Fe+Cu2+===Fe2++Cu可知,Cu2+的氧化性大于Fe2+。
答案:(1)Hg、Ag 该反应为可逆反应,及时抽出钾蒸气,导致平衡不断正向移动。 (2)Zn+2Fe3+===Zn2++2Fe2+ 3Zn+2Fe3++6H2O===2Fe(OH)3↓+3H2↑+3Zn2+[或Fe3++3H2OFe(OH)3+3H+,Zn+2H+===Zn2++H2↑。或写化学方程式也可以。]
(3)①Fe3+>Cu2+>Fe2+ ②方案:将铜棒与碳棒用导线连接,再插入氯化铁溶液,发现有电流产生,铜棒不断溶解,溶液由黄色变为蓝色或蓝绿色
14.下列关于元素周期表和元素周期律的说法错误的是( )
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
解析:Li、Na、K属同一主族,核外电子层数随着核电荷数增加而增多,A正确;根据元素周期律可推知第二周期元素从Li到F非金属性逐渐增强,B正确;Na与K比较,K更易失电子,还原性更强,C错;O与S同主族,O的非金属性强,D正确。
答案:C
13.下列事实中,能说明氯的非金属性比硫强的是( )
A.高氯酸(HClO4)的酸性比硫酸强
B.次氯酸的氧化性比稀硫酸强
C.氯化氢比硫化氢的热稳定性好
D.氯原子最外层电子数比硫原子最外层电子数多
解析:元素的非金属性指的是非金属元素原子的得电子能力。HClO4和H2SO4分别是氯、硫两元素最高价氧化物对应的水化物,HClO4酸性强,说明氯元素非金属性强,A项正确;B项比较的是次氯酸与稀硫酸的氧化性,这不能反映非金属性的强弱,B项错误;HCl比H2S稳定,说明氯原子比硫原子更易结合氢原子,C项正确;原子得电子能力与最外层电子数的多少无关,故D项错误。
答案:AC
12.在测定液态BrF3导电时,发现20℃时其导电性很强,说明BrF3能发生电离,其他众多事实证明KBrF4、(BrF2)2、SnF6、ClF3、BrF3等物质都是具有明显离子化合物倾向的盐。由此推断液态BrF3电离时的阴、阳离子是( )
A.Br3+和F- B.Br2F+和F- C.BrF和BrF D.BrF和BrF2+
解析:液态BrF3能导电,说明其电离方程式与H2O相同,即BrF3+BrF3 BrF+BrF。
BrF+BrF。
答案:C
11.下列对非金属元素(除稀有气体外)的相关判断正确的是( )
①非金属元素都是主族元素 ②单质在反应中都既能作氧化剂又能作还原剂 ③氢化物常温下都是气态,所以都叫气态氢化物 ④氧化物常温下都可以与水反应生成酸 ⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
A.②⑤ B.①③ C.①⑤ D.②③④
解析:非金属元素(除稀有气体外)都是主族元素,①正确;F2通常只能作氧化剂,②不正确;常温下水是液体,③错;CO、NO、SiO2等既不溶于水,也不与水反应,④错;在含氧酸根RO中,非金属元素R呈正价,⑤正确;选C。
答案:C
10.如下图是元素周期表中短周期的一部分,若A原子最外层的电子数比次外层少3,则下列说法正确的是( )
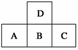
A.A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C>B>A
B.D的最高正价与B的最高正价相等
C.D与C不能形成化合物
D.原子半径的大小顺序是C>B>A>D
解析:A原子最外层的电子数比次外层少3,说明A只能为15号元素磷,则B、C、D依次为硫、氯、氧。A选项中酸性由强到弱的顺序为:高氯酸>硫酸>磷酸;B选项中氧元素无最高正价;C选项中氧和氯可形成氧化物如Cl2O7;D选项中原子半径的大小顺序是A>B>C>D。
答案:A
9.元素性质随着原子序数的递增呈周期性变化的根本原因是( )
A.核电荷数逐渐增大,元素化合价呈现周期性变化
B.元素的相对原子质量逐渐增大
C.核外电子排布呈由不稳定结构到稳定结构的周期性变化
D.元素原子半径呈由大到小的周期性变化
解析:结构决定性质,即原子的核外电子排布尤其是最外层电子排布决定了元素的性质。
答案: C
8. 已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>b B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ D.原子半径X<W
解析:根据各粒子都具有相同的电子层结构,可知:a-3=b-1=c+2=d+1,则a>b>d>c,A错;离子的还原性判断:核外电子数相同时,核电荷数越多,原子核对核外电子的引力越强,还原性越弱;对应的氢化物的稳定性越强,故B对C错;W与X位于同一周期,因a>b,所以原子半径W<X。
答案: B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com