
题目列表(包括答案和解析)
4.(2010·改编题)用铝箔包裹0.1 mol金属钠,用针在包好的铝箔上扎出一些小孔,放入水中,完全反应后,用排水法收集产生的气体,则收集到的气体为(标准状况)( )
A.O2和H2的混合气体 B.1.12 L H2
C.大于1.12 L H2 D.小于1.12 L H2
解析:发生的反应有①2Na+2H2O=2NaOH+H2↑
②2Al+2NaOH+2H2O===2NaAlO2+3H2↑。可见生成H2的物质的量大于0.05 mol即大于1.12 L。
答案:C
3.(2010·南京师大附中期中考题)为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
解析:A项中CO32-、SO42-均与Ba2+反应生成沉淀,最后得到的溶液为NaOH溶液。
答案:A
2.(2010·改编题)把一瓶不饱和的烧碱溶液分成4等份。保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是( )
A.加入的NaOH质量不一定最小
B.加入的Na2O2和Na2O的物质的量之比为1∶1
C.制成饱和溶液后,4份溶液中所含NaOH的质量相同
D.加入的Na2O2、Na2O的质量之比为1∶1
解析:由于固体NaOH不与水反应,溶液恰好饱和时,加入的NaOH的物质的量最大,其次是金属钠。再根据反应式:2Na2O2+2H2O===4NaOH+O2↑,2Na2O+2H2O===4NaOH,可知,二者消耗水的量相同,所以加入的物质的量也一定相同。因为原溶液相同,但4种物质消耗水的量不同,故制成饱和溶液后,4份溶液中所含m(NaOH)肯定不相同。
答案:B
0.15 mol HCl3 mol/L)→0.15 mol HCl3 mol/L)。
答案:CD
1.(2010·模拟题)某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。则下列分析与推理错误的是( )
|
|
50 mL盐酸 |
50 mL盐酸 |
50 mL盐酸 |
|
m(混合物) |
9.2 g |
15.7
g |
27.6
g |
|
V(CO2)(标况) |
2.24
L |
3.36
L |
3.36
L |
A.加入混合物9.2 g时盐酸过量
B.盐酸的物质的量浓度为3.0 mol/L
C.15.7 g混合物恰好与盐酸完全反应
D.根据表中数据不能计算出混合物中NaHCO3的质量分数
解析:根据9.2 g混合物产生0.1 mol CO2,推测若产生0.15 mol CO2时仅需13.8 g混合物,可见15.7 g混合物中加入50 mL盐酸时,混合物过量,盐酸完全反应,那么9.2 g混合物中加入50 mL盐酸时,盐酸过量,混合物完全反应,利用这一组数据可计算出混合物中NaHCO3的质量分数为45.65%。同样根据第2组数据或第3组数据可确定盐酸的物质的量浓度为3 mol/L(0.15 mol CO2→0.15 mol HCl50 mL3 mol/L)。
21.有些膨化食品包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰所属的物质类别是 (用序号填空)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂
(2)生石灰可作干燥剂的理由是(用化学方程式表示) 。
(3)你认为下列内容还必须在这种小纸袋上注明的是 (用序号填空)。
①禁止食用 ②可以食用 ③禁止未成年人用手拿 ④生产日期
(4)硅胶(主要成分是H2SiO3)也是一种很好的干燥剂。用硅胶作食品干燥剂比用生石灰好的理由是A__(用序号填空)。
①腐蚀性低 ②可释放出营养素 ③使用时间长
解析:二氧化硅的化学性质很稳定,无腐蚀性。
答案:(1)①②④ (2)CaO+H2O===Ca(OH)2 (3)①④ (4)①
20.①渗析 ②盐析 ③凝聚 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳 ⑧丁达尔现象 ⑨中和 ⑩水解。从中选出适宜的词语填入下列每小题的空格中:(填编号)
(1)肥皂水中透过强光,可以见到光带。这种现象称为 。
(2)在浓肥皂水中加入饱和食盐水(或固体含有的细粒)肥皂凝聚。这种现象称为 。
(3)在肥皂水中加入酚酞试液,肥皂水变成红色,说明高级脂肪酸根离子发生了 。
(4)在氢氧化铁胶体中加入硫酸铵,产生红褐色沉淀,这种现象叫做 。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做 。
解析:根据胶体的性质可以准确解答,但要注意肥皂水是胶体。
答案:(1)⑧ (2)② (3)⑩ (4)③ (5)①
19.中学化学中几种常见物质的转化关系如图:
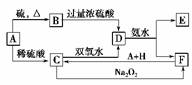
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: 。
(2)A、B、H的化学式:A 、B 、H 。
(3)写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象: 。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
解析:根据D溶液滴入沸水中可以得到以F为分散质的红褐色胶体,可知F为Fe(OH)3胶体,D中含Fe3+,因为D是B与过量浓H2SO4反应得到,所以D为Fe2(SO4)3溶液。再根据ACD,可知A为Fe,C为FeSO4,同时可知B为FeS。根据D与氨水的反应,可知E为(NH4)2SO4。根据Fe(OH)3胶体加入Fe(A)与H可得到FeSO4溶液,说明H是H2SO4。
答案:(1)1 nm-100 nm (2)Fe FeS H2SO4(稀) (3)2Fe2++H2O2+2H+===2Fe3++2H2O (4)取少量E放于试管中,用胶头滴管滴入NaOH溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝。(或其他合理答案) (5)4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+
18.现有BaCl2,MgSO4,(NH4)2SO4、KCl、AgNO3、和KOH六种未知溶液,为了鉴别它们,将它们任意编号为A、B、C、D、E、F,现将它们两两混和(必要时可微热),实验结果如右表。(其中“-”表示无明显现象,“↑”表示生成气体,“↓”表示生成沉淀或微溶物质)则A. 、B. 、C. 、D. 、E. 、F. 。
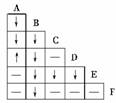
解析:这是一道推断题,主要考查了碱与盐、盐与盐的反应规律的应用。若盐与盐能反应,则生成物中必定生成沉淀或微溶物质,若无明显现象,则说明盐与盐不能反应,若碱与盐反应时,一般生成沉淀,(当铵盐与可溶性碱作用时必有气体NH3和水生成)若无明显现象则说明该碱和盐不能反应,利用这些反应的特征现象,从而可推断出各种物质,由表可知B物质能与其它五种物质均能反应且都有沉淀生成,则B物质为AgNO3,而F只与B反应,与其它四种物质均不反应,则F为KCl。A与D能反应且能放出气体,则A、D应为(NH4)2SO4和KOH,而A能与C反应生成沉淀,不能与E反应,D能与E反应产生沉淀,不能与C反应,故A应为(NH4)2SO4,D应为KOH,C为BaCl2,E为MgSO4。
答案:(NH4)2SO4 AgNO3 BaCl2 KOH MgSO4 KCl
17.有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 。
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为A__。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 。
解析:本题通过对硫、氯、铁三种常见元素的推断,主要考查了化学方程式、离子方程式的书写,胶体知识,有关热量问题的计算和氧化还原反应的计算等问题,注重考查学生的分析能力和判断能力。
因X2-、Y-均与Y的氢化物具有相同的电子数,说明X、Y同周期,且分别属ⅥA和ⅦA族元素,又根据ZY3溶液遇苯酚呈紫色,推知ZY3为FeCl3,即X、Y、Z分别是硫、氯、铁元素,从而可如下作答:(1)为HClO4,(2)Fe3++3H2O△,Fe(OH)3(胶体)+3H+,因此液体为胶体,因而具有a、b、d的性质。关于(3)问,因X的单质在空气中燃烧产生的气体为SO2,SO2与O2的反应是可逆反应,根据题设条件,产生176.4 kJ热量时消耗的气体(SO2)的物质的量为1 mol×=1.8 mol,所以其转化率为×100%=90%.再由题设条件中Y的含氧酸盐常用于制O2,知该盐为KClO3,所以Y的酸为HClO3,故SO2与1.5 mol HClO3反应转移1.5×6.02×1023个电子时的化学方程式为SO2+2HClO3===H2SO4+2ClO2。
答案:(1)HClO4
(2)Fe3++3H2OFe(OH)3(胶体)+3H+ abd
(3)①90% ②SO2+2HClO3===H2SO4+2ClO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com