
题目列表(包括答案和解析)
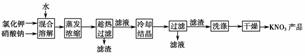
13.(2010·模拟题)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
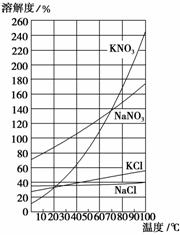
硝酸钾等四种物质的溶解度随温度变化如图所示。
回答下列问题:
(1)为了加速固体溶解,可采取的措施是____________________________________。
(2)实验室进行蒸发浓缩操作时,将蒸发皿置于铁圈上,用酒精灯加热。取用蒸发皿应使用 (填仪器的名称),为了防止液滴飞溅,进行的操作是 _______________________________________。
(3)“趁热过滤”操作中,滤渣的主要成分是(填化学式) 。
(4)“趁热过滤”后,有时先往滤液中加入少量水,加热至沸,然后再“冷却结晶”,目的是__ 。
(5)制得的KNO3产品中常含NaCl,进一步提纯的方法是________________________
_____________________________________________________________ 。
解析:本题考查学生对溶解、蒸发、过滤、结晶、重结晶等基本操作的理解,对化学现象提出科学合理的解释,实验室一般事故的预防。“趁热过滤”后的滤液对NaCl来讲是饱和溶液,为防止降温过程中NaCl的析出,往往需要先往滤液中加入少量水,使其变成NaCl的非饱和溶液再降温以析出产品。
答案:(1)搅拌、加热 (2)坩埚钳 用玻璃棒不断搅拌滤液 (3)NaCl (4)稀释溶液,防止降温过程中NaCl析出,提高产品纯度 (5)重结晶
12.(2009·四川理综)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2∶3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与A的水溶液反应生成蓝色沉淀。
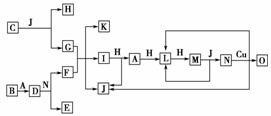
请回答下列问题:
(1)组成B单质的元素位于周期表第________周期,第________族。化合物C的电子式为_________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是______________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:____________________。
(4)写出D与足量的N反应生成E和F的化学方程式:__________________________。
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有________个。
解析:根据B是由短周期元素组成的单质,B与冷水缓慢反应,与沸水迅速反应,放出氢气,确定B为金属镁。D是一种离子化合物,其阴阳离子的个数比为2∶3,且能与水反应得到两种碱,确定D为二氮化三镁,A为氮气。C为淡黄色固体化合物,推测为过氧化钠。O能与A的水溶液反应生成蓝色沉淀,说明有氢氧化铜生成。通过分析可得:A:氮气,B:镁,C:过氧化钠,D:二氮化三镁,E:硝酸镁,F:硝酸铵,A:氢氧化钠,H:氧气,I:氨气,J:水,K:硝酸钠,L:一氧化氮,M:二氧化氮,N:硝酸,O:硝酸铜。
答案:(1)三 ⅡA Na+[:····:····:]2-Na+
(2)水分子之间存在氢键比硒化氢的分子间作用力强
(3)4NH3+3O22N2+6H2O
(4)Mg3N2+8HNO3===3Mg(NO3)2+2NH4NO3
(5)2
11.在一定条件下,NO跟NH3可以发生反应,生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,经还原得到的N2比经氧化得到的N2多1.4 g。
(1)写出反应的反学方程式。
(2)若以上反应进行完全,试计算反应混合物中NO与NH3的物质的量可能各是多少。
解析:NO与NH3反应生成N 2和H2O时,化学方程式为:6NO+4NH3===5N2+6H2O 6 mol NO被还原得到3 mol N2,4 mol NH4被氧化得到2 mol N2经还原得到的N2比经氧化得到的N2多1 mol,即多28 g。现在反应中多1.4 g,则可能参加反应的NO为0.3 mol,NH3过量;或参加反应的NH3为0.2 mol,NO过量。
解:设混合物中NO的物质的量为x,NH3的物质的量为y。
若NO不足,则:
6NO + 4NH3===5N2+6H2O Δm
6 mol 4 mol 28 g
x 1.4 g
x==0.3 mol y=1 mol-0.3 mol=0.7 mol
若NH3不足,则:
6NO + 4NH3===5N2+6H2O Δm
6 mol 4 mol 28 g
y 1.4 g
y==0.2 mol x=1 mol-0.2 mol=0.8 mol。
答案:(1)6NO+4NH3===5N2+6H2O
(2)当NH3过量时,n(NO)=0.3 mol,n(NH3)=0.7 mol;当NO过量时,n(NO)=0.8 mol,n(NH3)=0.2 mol。
10.(2010·太原四中期中考题)工业生产中物质的循环利用有多种模式。例如:
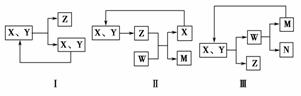
下列表述正确的是 ( )
A.图Ⅰ可用于合成氨中N2、H2的循环
B.图Ⅰ可用于氨碱法制纯碱中CO2的循环
C.图Ⅱ可用于电解饱和食盐水中NaCl的循环
D.图Ⅲ可用于氨氧化法制硝酸中NO的循环
解析:本题考查的是对图形的认知及工业生产原理的理解。A正确;B中的氨碱法制纯碱的原理是NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓,由于反应物有四种,而Ⅰ图中的反应物只有两个,所以B错;同理电解食盐水的生成物有NaOH、Cl2、H2,图Ⅱ中的X+Y===Z,只有一个生成物,所以C错;D中氨氧化法制硝酸的原理是氨的催化氧化、NO的氧化、NO2与H2O反应,而图Ⅲ中W―→M+N,很明显不符合反应事实,故D也不对。
答案:A
9.(2010·模拟题)将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为 ( )
A.0.5a mol B.(0.1+a) mol C.0.1a mol D.2a mol
解析:首先判断Cu与硝酸谁过量,经判断知HNO3过量,Cu全部反应,根据溶液中的电荷守恒,n(NO3-)=n(H+)+2n(Cu2+)。n(Cu2+)==0.05 mol,
所以n(NO3-)=a mol+0.05 mol×2=(a+0.1) mol。
答案:B
方法归纳:在变化中寻找一个不变量,这就是“守恒”的实质。因此要灵活利用好电子守恒法、原子守恒法、电荷守恒法等守恒方法。
8.(2010·天津八校联考题)进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习方法之一。下列对有关实验事实的解释正确的是 ( )
A.酸性高锰酸钾溶液中通入SO2后,颜色褪去,说明SO2表现了漂白性
B.把铁粉投入到相同浓度的Cu(NO3)2和AgNO3混合溶液,首先析出的是Ag,说明Ag+的还原性比Cu2+强
C.常温下,将铝片放入浓硫酸中无明显现象,说明铝不和冷的浓硫酸反应
D.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
解析:A项中表现了SO2的还原性;B项中发生的反应依次为:①Fe+2Ag+===Fe2++2Ag;②Fe+Cu2+===Cu+Fe2+,所以氧化性由强到弱的顺序为Ag+>Cu2+;C项中铝与冷浓硫酸先反应使铝钝化;D项中浓硝酸光照分解生成红棕色的NO2溶解于浓硝酸中而使其变黄,D项正确。
答案:D
7.(2010·莱芜十七中期中考题)下列关于非金属的说法中正确的是 ( )
①常温下为气体的单质都是由非金属组成 ②非金属氧化物都可以与水发生化合反应 ③非金属元素都是主族元素,其最外层电子数都大于或等于4 ④因为非金属具有得电子的性质,其单质均不能作还原剂 ⑤溶于水生成酸的物质一定是酸性氧化物 ⑥非金属元素可以形成分子晶体、原子晶体和离子晶体
A.①⑥ B.②③⑤ C.②④⑥ D.③④
解析:①正确,有H2、F2、Cl2、O2、N2及稀有气体He、Ne、Ar、Kr、Xe等;
②不正确,如SiO2,CO、NO等不成盐氧化物不能与水发生化合反应;③不正确,都是主族元素正确,但H、B最外层电子数都小于4;④不正确,H2、C是常用的还原剂,S以弱氧化性为主;⑤不正确,Cl2、NO2溶于水后均能生成酸,但它们均不是酸性氧化物;⑥正确,如I2,金刚石,NH4NO3。
答案:A
6.(2010·模拟题)如图所示,将Cu(NO3)2·6H2O加热充分反应,关于A物质的说法正确的是
( ) 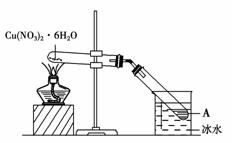
A.A物质有挥发性
B.A物质是硝酸铜溶液
C.物质的质量分数约为58.3%
D.A物质的质量分数约为63.5%
解析:首先搞清楚发生的反应有①Cu(NO3)2·6H2OCu(NO3)2+6H2O;②2Cu(NO3)22CuO+4NO2↑+O2↑;③4NO2+O2+2H2O===4HNO3。显然A物质为硝酸溶液。假设起始有2 mol Cu(NO3)2·6H2O,所得硝酸溶液的质量分数为×100%=58.3%。显然AC正确。
答案:AC
5.(2010·模拟题)在下列溶液中,各组离子一定能够大量共存的是 ( )
A.含有0.1 mol·L-1 Fe3+的溶液:K+、Mg2+、I-、NO3-
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.含有大量HCO3-的澄清透明溶液:K+、NH4+、Cl-、Na+
D.pH=7的溶液:Fe3+、Mg2+、SO42-、Cl-
解析:因为Fe3+能将I-氧化,所以A项不符合题意。能使石蕊试液变红,说明溶液显酸性,那么酸性条件下,NO3-能将Fe2+氧化,B项不符合题意。pH=7的溶液中不会有大量的Fe3+存在,D项不符合题意。
答案:C
4.a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
A.(a+b)×63 g B.(a+b)×189 g
C.(a+b) mol D. mol
解析:生成的Fe(NO3)3肯定为(a+b )mol,即有3(a+b) mol未被还原;被还原的硝酸也可以根据电子转移进行计算确定为(a+8a+b)/3 mol,那么未被还原的也可以表示为 mol。
答案:BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com