
题目列表(包括答案和解析)
8.某有机物的结构简式为CH3-CH=CH-Cl,该有机物能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色
⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应
A.以上反应均可发生 B.只有⑦不能发生
C.只有⑥不能发生 D.只有②不能发生
解析:有机物性质主要由分子内的结构特征所决定。该物质属卤代烯烃,因此能发生双键和卤代烃的反应,但由于氯原子与碳原子是以共价键结合,不是自由移动的Cl-,故不可直接与AgNO3溶液反应,只有碱性条件下水解之后酸化才可与AgNO3溶液反应,产生白色沉淀。
答案:C
7.(2009·蕲春四中月考)美国媒体2008年9月15日报道:某牙膏中含有的消毒剂三氯生,
遇含氯的自来水能生成氯仿(三氯甲烷),氯仿能导致肝病甚至癌症,已知三氯生的结构简
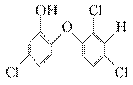
式为: ,下列有关说法不正确的是( )
A.三氯生的分子式为C12H7Cl3O2 B.氯仿不存在同分异构体
C.三氯生能与NaOH溶液反应 D.三氯生易溶于水
解析:三氯生有酚羟基,故可与NaOH溶液反应;因三氯生分子中含两个苯环,而只有一个亲水羟基,故不易溶于水;氯仿即三氯甲烷,无同分异构体。
答案:D
6.以氯乙烷制1,2?二氯乙烷,下列转化方案中,最
好的是 ( )
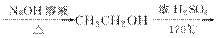
A.CH3 CH2Cl CH2CH2CH2ClCH2Cl
B.CH3CH2ClCH2ClCH2Cl
C.CH3CH2ClNaOH的醇溶液△CH2=CH2CH3CH2ClCH2ClCH2Cl
D. CH3CH2ClNaOH的醇溶液△CH2=CH2CH2ClCH2Cl
解析:由氯乙烷生成1,2?二氯乙烷的过程应为:CH3CH2ClCH2=CH2Cl2加成CH2ClCH2Cl。
答案:D
5.(2009·武汉模拟)分子式是C3H6Cl2的有机物,若再有一个H原子被Cl原子取代,则生成的C3H5Cl3有两种同分异构体,则原有机物C3H6Cl2应该是 ( )
A.1,3-二氯丙烷 B.1,1-二氯丙烷
C.1,2-二氯丙烷 D.2,2-二氯丙烷
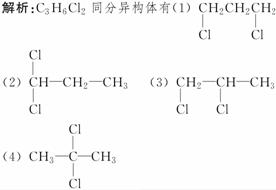
若(1)中的一个H被取代时,有2种情况,(2)有3种情况,(3)有3种情况,(4)有1种情况。
答案:A
4.1-氯丙烷和2-氯丙烷分别在NaOH的乙醇溶液中加热反应,下列说法正确的是( )
A.生成的产物相同 B.生成的产物不同
C.C-H键断裂的位置相同 D.C-Cl键断裂的位置相同
解析:1?氯丙烷和2?氯丙烷分别在NaOH的乙醇溶液中发生消去反应的方程式为:
 ;
;
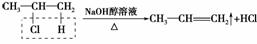
二者的产物相同,但CH、CCl键的断裂位置不同。
答案:A
3.为检验某卤代烃(R-X)中的X元素,有下列实验操作:
①加热煮沸 ②加入AgNO3溶液 ③取少量卤代烃 ④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却,正确操作的先后顺序是 ( )
A.③①⑤⑥②④ B.③①②⑥④⑤
C.③⑤①⑥④② D.③⑤①⑥②④
解析:检验卤代烃中的卤素,先让卤代烃在碱性条件下水解,再加硝酸中和剩余的碱,最后才能加硝酸银。
答案:C
2.下列卤代烃中沸点最低的是( )
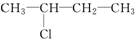 A.CH3CH2CH2Cl B.
A.CH3CH2CH2Cl B.
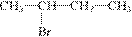 C.CH3CH2CH2BrE D.
C.CH3CH2CH2BrE D.
解析:本题主要考查卤代烃物理性质中沸点的变化规律,碳原子越多沸点越高。
答案:A
1.下列有机物中,不属于烃的衍生物的是( )
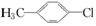
 ?
?
解析: 可看作甲苯分子中的一个氢原子被Cl取代;CH3CH2NO2可看作CH3CH3分子中的一个氢原子被硝基取代;CH2CHBr可看作CH2CH2分子中的一个氢原子被Br原子所取代的产物,因此,只有?CH2CH2?不属于烃的衍生物。
答案:D
15.25℃,NaOH和Na2CO3两溶液的pH均为11。
(1)两溶液中,由水电离出的c(OH-)H2O分别是:
①NaOH中________;②Na2CO3中________;
③在1 L水中加入上述________会使水的电离程度减小。
(2)各取10 mL上述两种溶液,分别加水冲稀到100 mL, pH变化较大的是
________(填
化学式)溶液。
(3)现有0.1 mol/L的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是
______________________________________________________________。
纯碱溶液呈碱性的原因(用离子方程式表示)是______________,你认为该溶液pH的
范围一定介于________之间。
(4)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
答案:(1)①1.0×10-11 mol/L ②1.0×10-3 mol/L ③NaOH (2)NaOH
(3)把一小块pH试纸放在表面皿(或玻璃片上),用蘸有待测液的玻璃棒点在试纸的中
部,试纸变色后,与标准比色卡比较来确定溶液的pH CO32-+H2OHCO3-+
OH- 7-13
(4)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,
产生白色沉淀,且溶液的红色褪去。这可以说明纯碱溶液呈碱性是由CO32-引起的。
14.(1)25℃时,0.1 mol/L NaOH溶液的pH为________;
(2)25℃时,0.1 mol/L NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原
因是_________________________________________________________
____________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
解析:0.1 mol/L NaOH溶液的c(OH-)=0.1 mol/L,c(H+)= mol/L=10-13
mol/L, pH=-lg[c(H+)]=13;由于NH4+能结合水电离出来的OH-生成弱电解质
NH3·H2O,破坏了水的电离平衡,使溶液显酸性;将两种溶液等体积混合,发生反
应: NaOH+NH4Cl===NaCl+NH3·H2O,Na+和Cl-均不水解,故浓度相等,
NH3·H2O能电离出OH-,使c(OH-)>c(H+)。
答案:(1)13 (2)< NH4++H2ONH3·H2O+H+ (3)C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com