
题目列表(包括答案和解析)
13.用中和滴定法测定某烧碱的纯度。
(1)配制待测液
将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要
仪器有________________________________。
(2)滴定
①盛装0.20 mol·L-1盐酸标准液应该用________式滴定管,盛装前对滴定管的要求是:
______________。
②滴定时,应先向锥形瓶中加________滴________作指示剂;滴定过程中两眼应注视
__________________;当____________________时为滴定终点。
③有关数据记录如下:
|
滴定序号 |
待测液体体积(mL) |
|
|
|
所消耗盐酸标准液的体积(mL) |
|
|
|
|
滴定前 |
滴定后 |
|
|
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
26.00 |
(3)纯度计算:NaOH溶液的浓度为________ mol·L-1,烧碱样品的纯度为________。
(4)对几种假定情况的讨论:
①若用蒸馏水冲洗锥形瓶,则会使测定结果________;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果________;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果________;
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果________。
解析:这是一考查学生的溶液配制、中和滴定操作等综合能力的题目。解此题时应以操
作为主线,以c(待测)为前提,联想每步操作中所用仪器及操作不当所引起的
误差。
答案:(1)烧杯、玻璃棒、200 mL容量瓶、胶头滴管
(2)①酸 用蒸馏水洗净后,还需用标准溶液润洗2-3次 ②2-3 甲基橙 锥形瓶内
溶液颜色变化 滴入最后一滴,溶液的颜色突变为橙色且半分钟内不褪色
(3)0.201 94.6% (4)①无影响 ②偏高 ③偏低 ④偏低
0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
KMnO4+FeSO4+H2SO4===Fe2(SO4)3+MnSO4+K2SO4+
H2O
(2)在滴定实验中不能选择________式滴定管,理由是__________________________;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________和
________(铁的相对原子质量以55.9计);
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断
和分析。
①方案一________(填“准确”、“不准确”或“不一定准确”),理由是__________;
②方案二________(填“准确”、“不准确”或“不一定准确”),理由是________________________________________________________________________。
解析:本题考查氧化还原反应的配平,定量分析和测定等知识。
(1)根据氧化还原反应中,化合价升降总数相等和元素守恒进行配平。
(2)KMnO4溶液具有强氧化性,不能用碱式滴定管,因为KMnO4能腐蚀碱式滴定管下
面的乳胶管。
(3)方案一:根据反应关系Fe-H2,氢气的物质的量
n(H2)=(mol)。
m(Fe)=×55.9=1.45(g),铁的质量分数为。
方案二:由反应关系式:5Fe-KMnO4,
m(Fe)=5×0.020 00×25×10-3×55.9=0.140(g)
铁的质量分数为=。
(4)见答案。
答案:(1)2 10 8 5 2 1 8
(2)碱 KMnO4溶液是强氧化剂,会腐蚀乳胶管
(3)
(4)①不一定准确 如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结
果偏高;如果铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致
结果偏低;如果上述情况均不存在,则结果准确
②不一定准确 如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸
性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的
铁的氧化物,生成的Fe3+在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果
上述情况均不存在,则结果准确
12.为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下
数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状
况);
方案二:将 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用
11.(2010·苏州模拟)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯
度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液;
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙
指示剂;
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记
下开始刻度V1 mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点消耗硫酸体积为V2 mL。
回答下列问题:
(1)正确的操作步骤是(填写字母)
________→________→________→D →________。
(2)操作中锥形瓶下垫一张白纸的作用是__________________________。
(3)操作D中液面应调整到________;尖嘴部分应________。
(4)滴定到终点时锥形瓶内溶液的颜色变化是________。
(5)若酸式滴定管没用标准H2SO4溶液润洗,会对测定结果有何影响________(填“偏
高”、“偏低”、或“无影响”,其他操作均正确)。
(6)该烧碱样品的纯度计算式是___________________________________________。
思路点拨:本题给出的主要信息是中和滴定的各步操作,可以实验实际为基础排列
出实验步骤的先后顺序。进行误差分析时,应将错误操作归结为消耗标准溶液的体
积偏大还是偏小或无影响。
A→A→B→D→E。
(2)放一白纸便于准确观察滴定终点时溶液的颜色变化情况。
(3)调整液面时应调至零刻度或零刻度以下某一刻度。尖嘴部分应充满溶液,无气泡。
(4)终点时溶液颜色由黄色变为橙色。
(5)若酸式滴定管没有用标准H2SO4润洗,则滴定时消耗H2SO4溶液的体积偏大,所测
烧碱溶液浓度会偏高。
(6)滴定时消耗溶质H2SO4物质的量为 mol
则反应掉NaOH的物质的量为2 mol。
NaOH的纯度为:×100%=%。
答案:(1)C A B E
(2)便于准确观察滴定终点时溶液的颜色变化情况
(3)零刻度或零刻度以下的某一刻度 充满溶液,无气泡
(4)由黄色变为橙色
(5)偏高 (6)%
10.有①②③三瓶体积相等、物质的量浓度都是1 mol/L的HCl溶液,将①加热蒸发至
体积减少一半,在②中加入少量CH3COONa固体(加入后溶液仍呈强酸性),③不
作改变。然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH
溶液的体积是 ( )
A.①=③>② B.③>②>① C.③=②>① D.①=②=③
解析:这是一道化学学科内有关化学实验、酸碱中和滴定、电离平衡移动、盐类水
解等的综合题。“陷阱”设在①中,蒸发时溶液中的水分子和HCl分子将同时挥
发出来,溶液中HCl的物质的量要降低;对于②中加入CH3COONa固体,
CH3COO-+H+ CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中
CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中
和,所以消耗NaOH的体积不会变化。
答案:C
2。
答案:D
9.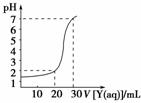 如右图为对10 mL一定物质的量浓度的盐酸X用一定物质的量
如右图为对10 mL一定物质的量浓度的盐酸X用一定物质的量
浓度的NaOH溶液Y滴定的图象,依据图象推出X和Y的物质
的量浓度是下表内各组中的 ( )
|
选项 |
A |
B |
C |
D |
|
X/(mol·L-1) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y/(mol·L-1) |
0.04 |
0.12 |
0.09 |
0.03 |
解析:由题图象:c(HCl)·V(HCl)=c(NaOH)·V(NaOH),==
=,由表中知A、D属此种情况。但A组中,X=0.12 mol/L,c(H+)=0.12 mol/L,
pH<1,不符合图象;D组X=0.09 mol/L,pH>1,加入20 mL NaOH后溶液的pH
为: c(H+)==10-2 mol/L,pH=-lg10-2=
8.(2010·安溪测评)准确量取25.00 mL KMnO4溶液于锥形瓶中并用某无色未知浓度的还原性A溶液进行滴定,所选仪器和指示剂均正确的是 ( )
A.50 mL酸式滴定管;甲基橙 B.50 mL碱式滴定管;酚酞
C.50 mL量筒;石蕊 D.50 mL酸式滴定管;不用指示剂
解析:KMnO4等强氧化剂易氧化碱式滴定管的橡皮管,故应选用酸式滴定管;
KMnO4
溶液本身是一种紫色溶液,恰好反应后溶液变成无色,故滴定时不用指示剂。
答案:D
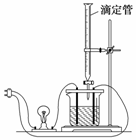
7.利用右图装置做下面的实验:在烧杯里盛半杯乙溶液,
然后用滴定管向容器中滴入甲溶液,随着甲的滴入,电灯渐
渐变暗,滴到一定量时,电灯完全熄灭,继续滴入甲溶液,
电灯又会逐渐亮起来。下列各组溶液中(甲在前,乙在后),
能够产生上述现象的是 ( )
A.NH3·H2O、AgNO3 B.CH3COOH、NH3·H2O
C.NaOH、AlCl3 D.H2SO4、Ba(OH)2
解析:C选项虽可完全生成Al(OH)3沉淀,但同时生成NaCl,
灯泡不会熄灭。
答案:D
6.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶
液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于
Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比
是 ( )
A.1∶9 B.1∶1 C.1∶2 D.1∶4
解析:本题主要考查有关pH的简单计算。设Ba(OH)2溶液的体积为V1,NaHSO4溶液的体积为V2,浓度为c2,则由Ba2++SO42-===BaSO4↓有:×10-2 mol·L-1·V1=c2·V2①
又由于混合后溶液的pH=11得:=10-3 mol·L-1②
解①②可得:V1∶V2=1∶4
 答案:D
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com