
题目列表(包括答案和解析)
12.4 g 0.4 mol
则=
则Mr(X)=16为O元素,其它各项由此而求出。
答案:Ⅰ.(1) (2)34-m (3)NA
Ⅱ.(1)108 g·mol-1 (2)62 g·mol-1 62 16 Na2O
13.(2010·模拟题)Ⅰ.根据下列数据判断元素X的相对原子质量
(1)1.01×105 Pa,273℃时气态单质Xn的密度为d g/L,则X的相对原子质量为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
Ⅱ.(1)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(2)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为________,其相对分子质量为________,X的相对原子质量为________,该物质的化学式为________。
解析:Ⅰ.(1)在273℃时,气体摩尔体积是标况下的2倍,即Vm=2×22.4 L·mol-1=44.8 L·mol-1Xn的相对分子质量为44.8d,X的相对原子质量是。
(2)HmX的相对分子质量为17×2=34,则X的相对原子质量为34-m。
(3)一个X原子的质量为 g,1 mol X的质量为 g·NA,则X的相对原子质量为NA。
Ⅱ.(1)依据质量守恒定律,m(E)=(20 g+14 g)-(8.8 g+3.6 g)=21.6 g
则M(E)===108 g·mol-1
(2)Na2X - 2Na+ - X2-
[46+Mr(X)]g 2 mol
12.(2010·原创题)某气体的摩尔质量是M g·mol-1,分子数为X,在标准状况下所占的体积是V L,质量是m g。某元素原子的摩尔质量是A g·mol-1,原子个数是Y。阿伏加德罗常数为NA,试说明下列各式表示的意义。
(1)___________________________ _______________________________。
(2)___________________________________________________________。
(3)____________________________________________________________。
(4)____________________________________________________________。
(5)______________________________________________ ____________。
解析:本题主要考查物质的量、摩尔质量、阿伏加德罗常数、气体摩尔体积的概念及物质的量、粒子数、质量、气体体积之间的相互求算。解答的关键是正确理解有关概念的意义。
答案:(1)一个气体分子的质量 (2)原子的物质的量 (3)气体的密度 (4)气体的物质的量 (5)气体的密度
11.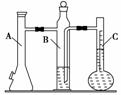 (2010·模拟题)利用右图所示实验装置可以测定一定条件下1 mol
(2010·模拟题)利用右图所示实验装置可以测定一定条件下1 mol
气体的体积。图中仪器C称为液体量瓶,瓶颈上有110-130 mL
刻度线。将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反
应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体
积可以转换成H2的体积。
实验步骤
①装配好化学反应气体体积测定仪,作气密性检查。
②用砂纸擦去镁带表面的氧化物,然后称取0.100-0.110 g的镁带,把数据记录于表格。
③取下A瓶加料口的橡皮塞,用小烧杯加入20 mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口。
④用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平。
⑤用注射器吸取10 mL 3 mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将硫酸注入A瓶,注入后迅速拔出针头。
⑥当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格。
⑦用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格。
重复上述操作进行第二次实验,避免偶然误差。
根据上述实验方法回答下列问题:
实验室温度:25℃,压强,101 kPa。该条件下1 mol氢气体积的理论值为24.5 L。
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,_____________________
可以确认装置气密性合格。
(2)B中所装液体一般是________(填“水”或“品红”)。
A中发生反应的离子方程式为_________________________________________。
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
|
实验次数 |
m(Mg)g |
硫酸体积mL |
液体量瓶中 液体体积mL |
抽出气体体积mL |
氢气体积mL |
计算1 mol 氢气体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
X |
|
|
2 |
0.115 |
10.0 |
121.0 |
8.0 |
|
|
①上表中X=________;
②计算1 mol氢气体积:两次实验的平均值=________L;
③计算实验误差:×100%=________;
④引起该误差的可能原因是________(填字母)。
A.镁带中含有跟硫酸不反应的杂质 B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝 D.所用稀硫酸不足量
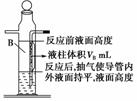 (4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温)。为此,某化学兴趣小组的同学对此实验方案提出了两条修正建议①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积。②B瓶中导管(图中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积。你认为他们的意见合理的是________(合理则填序号,否则填“无”)。
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温)。为此,某化学兴趣小组的同学对此实验方案提出了两条修正建议①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积。②B瓶中导管(图中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积。你认为他们的意见合理的是________(合理则填序号,否则填“无”)。
如有合理之处,请根据下面的数据给出修正的1 mol氢气体积的数学表达式。(镁元素的相对原子质量为24.3)
|
实验次数 |
m(Mg)g |
硫酸 体积mL |
液体量瓶中液体体积mL |
抽出气体 体积mL |
B瓶的一段液柱体积 mL |
水汽体积 百分含量 |
计算1 mol氢气体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
VB |
a% |
|
1 mol氢气体积=________L(填写数学表达式。)
解析:(1)微热A装置,系统内气体压强增大,趋向于把储液瓶(B瓶)内导管中液体通过导管压到装置C。
(2)B中所装液体用“品红”比“水”更直观鲜明。
(3)④镁带中含有杂质铝,致使生成的气体较理论值偏多。
(4)①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积。②B瓶中导管(图中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积。
答案:(1)储液瓶(B瓶)内导管中液面会上升,观察上升液面在1分钟内无明显下降
(2)品红 Mg+2H+===Mg2++H2↑ (3)①106.5 ②25.5 ③4.08% ④C
(4)①② 0.243(106.5-VB)(1-a%)
10.(2010·哈尔滨市九中期中考题)等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
解析:发生的反应有甲中:2Al+6HCl===3H2↑+2AlCl3;乙中为2Al+2NaOH+2H2O===3H2↑+2NaAlO2生成H2的体积比为5∶6,那么发生反应的Al的物质的量之比为5∶6,由于n(NaOH)=n(HCl),显然甲中Al过量,乙中碱过量。
答案:B
9.(2010·泗阳中学期中考题)已知Q与R的摩尔质量之比为9∶22,在反应X+2Y===2Q+R中,当1.6 g X和Y完全反应后生成4.4 g R,则参与反应的Y和生成物Q的质量之比为( )
A.46∶9 B.32∶9 C.23∶9 D.16∶9
解析:应用方程式中化学计量数之比等于物质的量之比,应用质量守恒:
X+2Y===2Q + R
2 mol 1 mol
∴∶=2∶1
∵M(Q)∶M(R)=9∶22,∴∶=2∶1 m(Q)=3.6 g
根据质量守恒则m(Y)=4.4 g+3.6 g-1.6 g=6.4 g
∴m(Y)∶m(Q)=6.4 g∶3.6 g=16∶9。
答案:D
8.(2010·邗江中学期中考题)某物质A在一定条件下加热分解,产物都是气体。分解方程式为2AB+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
A.7d B.5d C.2.5d D.2d
解析:根据题给出的方程式知,完全分解后生成气体的平均摩尔质量=[M(B)+2M(C)+2M(D)]/5。根据题意=d·M(H2)=d·2 g·mol-1,则:M(B)+2M(C)+2M(D)=5= 10d g·mol-1。
又根据质量守恒定律:2M(A)=M(B)+2M(C)+2M(D)。所以M(A)=5d g·mol-1,Mr(A)=5d。
答案:B
7.(2009·浙江)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA
B.1 mol乙烷分子含有8NA个共价键
C.58.5 g的氯化钠固体中含有NA个氯化钠分子
D.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA
解析:本题以阿伏加德罗常数为载体考查化学基本概念及原理。NO与O2混合后会发生反应,分子数将减少,A选项错误;乙烷分子中含有7个共价键,可以作出乙烷的结构式来看,B选项错误;氯化钠为离子晶体,不存在小分子,C选项错误;CO32-水解,1 mol可以水解生成1 mol HCO3-和1 mol OH-,CO32-+H2OHCO3-+OH-,故阴离子总数变大,D选项正确。
答案:D
6.(2009·江苏)用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4 L甲醇中含有的氧原子数为1.0NA
解析:本题考查阿伏加德罗常数。A项,pH=13也就是意味着c(H+)=1×10-13 mol·
L-1,则c(OH-)=1×10-1 mol·L-1,所以n(OH-)=c(OH-)×V=1×10-1 mol·L-1×1 L=0.1 mol,所以N(OH-)=0.1NA;B项,发生的化学反应方程式为Cl2+2NaOH===NaCl+NaClO+H2O(该反应为歧化反应),n(Cl2)=0.1 mol,那么转移电子的数目应该为0.1NA;C项,乙烯和丁烯的最简式都是CH2,则n(CH2)==1.5 mol,所以n(C)=1.5 mol,N(C)=1.5NA;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是1 mol,则所含有的氧原子个数也不为NA。
答案:C
5.(2009·福建)设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.24 g镁的原子最外层电子数为NA
B.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1NA
C.1 mol甲烷分子所含质子数为10NA
D.标准状况下,22.4 L乙醇的分子数为NA
解析:本题考查阿伏加德罗常数。一个Mg原子最外层有2个电子,24 g Mg的物质的量为1 mol,故最外层电子数为2NA,A错;乙酸为弱酸,在水溶液中不能完全电离,溶液中H+小于0.1NA,B错;1个甲烷分子含有10个质子,故1 mol甲烷分子含有质子数为10NA,C对;标准状况下,乙醇为液体,不能根据气体摩尔体积计算其物质的量,D错。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com