
题目列表(包括答案和解析)
13.(2010·模拟题)Ⅰ.1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。
O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图所示:呈Ⅴ
型,键角116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个
非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成
一个特殊的化学键(虚线内部分)--三个O原子均等地享有这4个电子。请回答:
(1)下列物质的分子与O3分子的结构最相似的是( )
A.H2O B.CO2 C.SO2 D.BeCl2
(2)O3分子是否为极性分子________(填“是”或“否”)。
(3)O3与O2间的转化是否为氧化还原反应________(若否,请回答①小题;若是,请
回答②小题)。
①O3具有强氧化性,它能氧化PbS为PbSO4,而O2不能,试配平:
________PbS+________O3--________PbSO4+________O2
②O3在催化剂作用下生成1 mol O2转移电子______mol。
Ⅱ.某一反应体系有反应物和生成物共七种物质:O2、KMnO4、MnSO4、H2SO4、
H2O2、H2O、K2SO4。已知该反应中H2O2只发生如下过程:H2O2―→O2。试回答下
列问题:
(1)该反应中的氧化剂是________。
(2)该反应中,发生还原反应的过程是________。
(3)配平下面化学反应的化学方程式:
KMnO4+H2O2+H2SO4===K2SO4+MnSO4+H2O+O2↑
(4)若反应转移了2 mol电子,则产生的气体在标准状况下的体积为______。
解析:Ⅰ.O3分子中的特殊化学键→O3分子中电荷
分布为: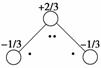 →O3分子是极性分子。O3→O2变化中有一个O降,两个
→O3分子是极性分子。O3→O2变化中有一个O降,两个
O均升→1 mol O3分解时转移 mol e-→生成1 mol O2时转化× mol e-。
Ⅱ.由O2→O2→H2O2作还原剂→KMnO4作氧化剂→MnSO4是还原产物→KMnO4与
H2O2物质的量之比是2∶5→配平(2、5、3,1、2、8、5)。
答案:Ⅰ.(1)C (2)是 (3)是 ②4/9
Ⅱ.(1)KMnO4 MnSO4 →MnSO4 (3)2 5 3 === 1 2 8 5 (4)22.4 L
12.(2008·北京理综)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是________(选填字母)。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红溶液褪色。简述用褪色的溶液区
别二者的实验方法
_______________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)
_______________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是____________。
②KCN溶液显碱性,原因是(用离子方程式表示)___
____________________________________________________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和
MmRn(m、n均为正整数)。若CR2质量为w1 g,MmRn质量为w2 g,M的相对原子质
量为a,则MmRn中m∶n=________(用含w1,w2和a的代数式表示)。
解析:本题考查原子结构与元素周期律。第三周期除稀有气体原子外,原子半径最
小的是氯元素,故X为Cl2。由Y+2I-+2H+===I2+Z+H2O知,Y为O3,Z为O2。
(1)Y与Z互为同素异形体。(2)臭氧具有强氧化性,能使品红溶液永久性褪色;二氧
化硫与品红溶液化合生成不稳定的无色物质,受热后溶液恢复至原来的颜色。(3)证
明氯气的氧化性比硫单质的强,其方法较多,最简单的方法是向硫化氢溶液中通入
氯气,溶液变浑浊。(4)HCN分子中每个原子最外层均达到稳定结构,故其结构式为
CHN。(5)Z为O2,MCR3是MCO3,反应的化学方程式为
O2+mMCO3===mCO2+MmOn
44m (am+16n)
w1 g w2 g
则44m:(am+16n)=w1 g∶w2 g,即m(44w2-aw1)=16nw1,故m∶n=16w1∶(44w2
-aw1)。
答案:(1)c (2)加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液
不变红,则原通入气体是O3
(3)2Fe+3Cl22FeCl3;Fe+SFeS(或H2S+Cl2===S↓+2HCl)
(4)①CHN ②CN-+H2OHCN+OH-
(5)16w1∶(44w2-aw1)
11.(2010·德州一中期中考题)为了探究铁与硫反应的产物中是否存在Fe2S3,某研究性
学习小组拟设计实验进行探究。他们查阅资料获得以下信息:在酸性溶液中2Fe3++
S2-===2Fe2++S↓;在碱性溶液中,Fe2S3不溶解,Fe2S3为黑色固体。实验操作步骤
如下:
①将铁粉和硫粉按一定质量比混合,在氩气存在的环境中,用灼热的玻璃棒点触混
合物粉末,反应即可发生并持续进行,冷却后得到黑色固体M。
②取黑色固体少许,加入浓氢氧化钠溶液并稍加热,冷却后过滤,得一黑色滤渣。
③将滤渣洗涤、烘干、称量、得其质量为8.8 g。
④向滤渣中先加入过量的硫酸溶液,再加入双氧水,最后加入过量的氢氧化钠溶
液,得到沉淀。
⑤将沉淀过滤、洗涤、灼烧、称量,得氧化铁质量为8.0 g。
(1)反应在稀有气体环境中进行的原因是
______________________________________________________________________;
铁粉与硫粉的混合粉末中,二者的量的关系是________,原因是
_______________________________________________________________________。
(2)用灼热的玻璃棒点触混合物粉末,反应即可发生并持续进行的原因是
_______________________________________________________________________;
加入浓氢氧化钠溶液并稍加热的目的是________,反应的离子方程式为
_______________________________________________________________________。
(3)通过计算可知,8.8 g固体产物中,铁、硫元素的质量比为________,由此得出的
结论是
______________________________________________________________________。
(4)步骤④中有关金属元素参加反应的离子方程式是
_______________________________________________________________________。
(5)为了探究上述黑色固体M的性质,他们设计了如下装置:
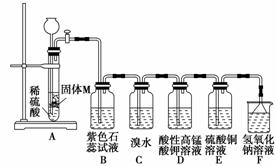
实验过程中,观察到E瓶中产生黑色沉淀。
①简述检验装置A气密性的方法:
_______________________________________________________________________。
②B中现象可能是________,D中的现象是
_______________________________________________________________________。
③写出C、E装置的离子方程式:
_______________________________________________________________________。
④推断M与稀硫酸反应产生的气体的性质:________。
a.酸性 b.还原性 c.氧化性 d.漂白性
解析:(3)依题意,实验最终的氧化物是氧化铁,n(Fe)=×2=0.1 mol,
m(Fe)=0.1 mol×56 g·mol-1=5.6 g,8.8 g固体产物中只含硫和铁,则m(S)=8.8 g-5.6
g=3.2 g,n(S)=0.1 mol,故m(Fe)∶m(S)=5.6 g∶3.2 g=7∶4,n(Fe)∶n(S)=0.1
mol∶0.1 mol=1∶1。
答案:(1)防止氧气参与反应 硫粉稍过量 防止铁与硫化铁反应,干扰实验结果
(2)铁与硫粉反应是放热反应 除去过量的硫 3S+6OH-===2S2-+SO32-+3H2O
(3)7∶4 铁与硫反应的产物中不存在Fe2S3,而全部是FeS
(4)FeS+2H+===Fe2++H2S↑ 2Fe2++H2O2+2H+===2Fe3++2H2O Fe3++3OH-
===Fe(OH)3↓
(5)①关闭活塞,向长颈漏斗中加入适量水,使漏斗中液面高于试管中液面,停止加
水,片刻后,液面差没有变化,表明装置A气密性良好 ②紫色石蕊试液变红色
溶液紫红色褪去 ③Br2+H2S===S↓+2Br-+2H+;H2S+Cu2+===CuS↓+2H+
④ab
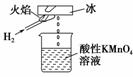
10.(2010·模拟题)张老师做了一个如图所示的实验(H2燃烧),发现烧杯中酸性KMnO4
溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断
下列说法中正确的是 ( )
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了只具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
解析:根据实验现象知,该物质既能与酸性高锰酸钾溶液反应,又能与氯化亚铁反
应,说明它既有氧化性又有还原性,H2+O2H2O2。2MnO4-+5H2O2+6H+
===2Mn2++5O2↑+8H2O,2Fe2++H2O2+2H+===2Fe3++2H2O。
答案:D
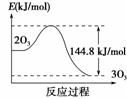
9.(2010·改编题)已知3O2(g) 2O3(g);ΔH=+144.8 kJ/mol且“Cl”大多数来自致冷剂氟利昂。
下列说法不正确的是 ( )
A.臭氧层中氟利昂释放出的氯原子是O3分解的催化剂
B.高压放电条件下O2可以生成O3
C.O3转变为O2的能量曲线可用右图表示
D.O3和O2为同素异形体
解析:从已知条件可判断A项叙述正确;也可以得出“2O3”的总能量比“3O2”的
总能量高144.8 kJ,那么不是最高处的能量比“3O2”的总能量高144.8 kJ,所以C
项不正确;雷雨过后,空气清新,就是因为打雷放电条件下,O2生成了O3的原因,
B项正确。
答案:C
8.(2010·广州五校联考题)近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是( )
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外电子层都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是H2S===2H++S2-
解析:A项,H2S加热时可发生分解反应;B项,H2S分子中H原子的最外层达到2
电子结构;C项,发生的反应为:H2S+Br2===2HBr+S↓,H2S能使溴水褪色;D
项,H2S是二元弱酸,应是分步电离。
 答案:C
答案:C
7.(2010·东营一中期中考题)已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化
性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子;若反应后S2O8n-变成
SO42-,反应中氧化剂与还原剂的离子数之比为5∶2,则S2O8n-中的n值和S元素的化合价是 ( )
A.2,+7 B.2,+6 C.4,+7 D.4,+4
解析:由题干条件可以写出以下反应:5S2O8n-+2Mn2++8H2O===10SO42-+2MnO4
-+16H+,根据电荷守恒可知n=2;结合信息,S2O82-中存在“---”,根据
电子转移可知,5 mol S2O82-转移10 mol e-,即每mol S2O82-转移2 mol e-,即一个
S2O82-中含有一个“---”,那么“S”元素在反应中化合价未发生变化,即
为+6价。
答案:B
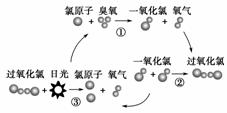
6.(2009·天津八校5月联考题)1995年三位美国科学家因在氟利昂和臭氧层方面的工作
获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,由图可知( )
A.日光在反应中作催化剂
B.过氧化氯是一种很稳定的物质
C.过氧化氯的结构式为O-Cl-Cl-O
D.臭氧分子最终转变成氧气分子
解析:A项,日光提供反应③的能量而非催化作用。由③知过氧化氯不是很稳定的
物质。根据化学键理论,过氧化氯的结构式应为Cl-O-O-Cl。O3经过循环最终变
为O2,臭氧层被破坏。
答案:D
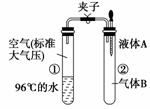
5.(2010·山西师大附中期中考题)青藏铁路于2006年7月1日全线通车,为防止旅客出现高原反应,列车上特备有氧气罐,青藏高原上水烧开的温度低于100℃。如图所示,夹子开始处于关闭状态,试管①内盛有96℃的水,①内的空气处于标准大气压。将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A与气体B的组合不可能是下列中的( )
A.氢氧化钠溶液、二氧化碳 B.硝酸钾溶液、氯化氢
C.水、氧气 D.水、二氧化氮
解析:96℃水立刻沸腾,说明液体A吸收了气体B,使整个系统内气体压强减小,
可见只有C项符合题意。
答案:C
4.(2010·模拟题)氢硫酸不稳定,要现用现配;从H2S的性质全面考虑,下列吸收H2S
制备氢硫酸的装置最合理的是( )
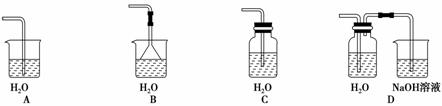
解析:H2S气体可溶于水,1体积水大约溶解2.6体积H2S,H2S有毒,不能随意排
放到大气中,可见只有D项符合题意。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com