
题目列表(包括答案和解析)
8.(2010·模拟题)铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与5.6 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A.16 g B.32 g C.64 g D.无法计算
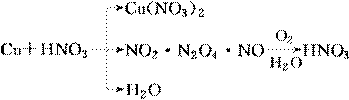
可见发生变价的元素有Cu和O,那么5.6 L O2(0.25 mol)得1 mol e-,Cu消耗0.5 mol即32 g。
答案:B
7.(2010·山东省实验中学月考题)据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KClO3+6P===3P2O5+5KCl,则下列有关叙述错误的是 ( )
A.上述反应中氧化剂和还原剂的物质的量之比为5∶6
B.白色烟雾是生成的P2O5白色固体小颗粒(烟)吸收空气中的水分,生成磷酸小液滴(雾)
C.反应中消耗1 mol P时,转移电子的物质的量为5 mol
D.因红磷和白磷互为同素异形体,所以上述火药中的红磷可以用白磷代替
解析:本题是一道STS题,涉及到化学知识在日常生活中的实际应用,较易。氯酸钾和红磷,经撞击发生的化学反应:5KClO3+6P===3P2O5+5KCl,KClO3作氧化剂,而P作还原剂,则A正确;P2O5白色固体小颗粒(烟)吸收空气中的水分,生成磷酸小液滴(雾)从而产生白色烟雾;P由0价变到+5价,则反应中每消耗1 mol P时,转移电子的物质的量为5 mol;虽然红磷和白磷互为同素异形体化学性质相似,但白磷易自燃,所以,上述火药中的红磷不能用白磷代替,否则,会引起火灾。
答案:D
6.(2010·改编题)“神舟七号”运载火箭的推进剂引燃后发生剧烈的反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量红烟,产生红烟的原因是 ( )

酒泉卫星发射现场
A.高温下N2和O2反应直接生成NO2
B.NO遇空气生成NO2
C.CO2催化NO转变成NO2
D.NO与H2O反应生成NO2
解析:火箭喷射出CO2、H2O、N2、NO后,NO遇空气迅速生成NO2。产生的红烟是含有NO2的固体小颗粒。
答案:B
5.(2010·模拟题)把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是 ( )
A.氧气 B.二氧化氮 C.二氧化氮和氧气 D.二氧化氮和一氧化氮
解析:发生的反应有①3NO2+H2O===2HNO3+NO
②HNO3+NaHCO3===CO2↑+H2O+NaNO3
③2CO2+2Na2O2===2Na2CO3+O2↑
④2NO+O2===2NO2。可假设开始有3 mol NO2,那么最后收集到1 mol NO2和0.5 mol O2。
答案:C
4.(2010·模拟题)每年春季是疾病、流行性传染病多发的季节。几年前的SARS至今让人心悸。最新的研究表明:一氧化氮吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述正确的是 ( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮不溶于水,能用排水法收集
解析:A项中NO是无色气体;B项中NO极易与空气中O2化合;C项中,假设含16 g氧元素 ,那么NO为1 mol,CO也为1 mol,C项正确;D项中符合NO的溶解性及收集方法,NO能用排水法而不能用排气法收集。
答案:CD
3.(2010·改编题)Na3N和NaN3都是离子化合物,又知Na3N与水反应生成氨气。下说法中正确的是
( )
A.Na3N与盐酸反应时可生成两种盐
B.Na3N在与水反应时作氧化剂
C.NaN3中N元素的化合价和Na3N中的N元素相同
D.Na+与N3-的电子层结构都与氖原子相同
解析:Na3N是Na+与N3-形成的离子化合物,而NaN3则是Na+与N3-(N3-是一个离子团,存在共价键)形成的离子化合物。A项中Na3N与HCl反应生成NaCl、NH4Cl,A项正确;Na3N与H2O发生的是水解反应,B项不正确;NaN3中N元素化合价为-价,Na3N中N元素为-3价,C项不正确;Na3N电子式为Na+[········Na+]Na+,D项错误。
答案:AD
2.(2010·山师附中月考题)在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是 ( )
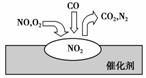
A.NO2是该过程的中间产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分包括CO和NO
D.催化转化总反应为2NO+O2+4CO4CO2+N2
解析:催化剂吸附尾气,使NO、O2反应生成NO2,CO和NO2在催化剂作用下发生反应4CO+2NO2===4CO2+N2,但是NO和O2反应不需要催化剂。
答案:B
1.(2010·模拟题)氮族元素与同周期的碳族、卤族元素相比较,下列变化规律正确的是 ( )
A.原子半径C<N<O B.非金属性Si<P<Cl
C.还原性SiH4<PH3<HCl D.酸性H2SiO3<H3PO4<H2CO3
解析:A项中应是C>N>O;B项根据同周期元素性质递变规律,非金属性Si<P<Cl,B项正确;C项应是SiH4>PH3>HCl;D项应是H2SiO3<H2CO3<H3PO4。
答案:B
6.(2010·天津八校联考题)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
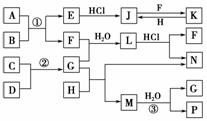
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H在常温下是气态;F、P和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G的分子构型为三角锥形;化合物M是由两种元素组成的四原子分子,共有58个电子。
(1)化合物E:___________________________________________________________;
中含有的两种元素是________。
(2)F的化学式是________;G的水溶液中,最多的阳离子是________。
(3)写出J与F反应的离子方程式:___________________________________________;
G与H反应的化学方程式为________________________________________________,
该反应中的还原剂是________,若1 mol H完全反应,则反应中转移的电子为
________mol。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。请用化学平衡移动原理加以解释:_________________________。
解析:由题意知,K为浅绿色溶液,即含Fe2+;F是形成酸雨的主要物质之一,且F具有漂白性,可知F为SO2;由L+HCI+F+N,又N是一种常见的氮肥,故L为(NH4)2SO3或NH4HSO3,N为NH4Cl;化合物G的分子构型为三角锥形,G为NH3;因为N为NH4Cl,推测H为Cl2;根据G+H→F+N,又N是一种常见的氮肥,故L为(NH4)2SO3或NH4HSO3,N为NH4Cl;化合物G的分子构型为三角锥形,G为NH3;因为N为NH4Cl,推测H为Cl2;根据G+H→N+M,即NH3+Cl2→NH4Cl+M,结合M是由两种元素组成的四原子分子,共有58个电子,故M为NCl3;至此,依据题给的框图关系,得出A为FeS2,B为O2,C、D分别为N2、H2,E为Fe2O3。
答案:(1)S、Fe
(2)SO2 NH4+
(3)2Fe3++SO2+2H2O===2Fe2++SO42-+4H+4NH3+3Cl2===NCl3+3NH4ClCl2 1
(4)饱和H水溶液中存在平衡:Cl2+H2OH++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
0.6 mol·(L·s)-1 13.3% (4)H2(g)+Cl2(g)===2HCl(g);ΔH=-184.6 kJ·mol-1 (5)NH3、H2 NH4+水解呈酸性,镁与H+反应产生H2,NH4+的水解平衡右移,生成的NH3·H2O会分解产生NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com