
题目列表(包括答案和解析)
1. 分子式为C5H12O2的二元醇有多种同分异构体,其中能够氧化成主链上碳原子为3的二元醛有x种,能氧化成主链上碳原子数为4的二元醛有y种,则x、y的值是( )
A.x=2 y=6 B.x=1 y=7
C.x=1 y=1 D.x=2 y=1
解析:能氧化成醛的醇必须具有-CH2OH的结构,如果二元醇氧化为二元醛,必须符合HO-CH2-R-CH2-OH的结构,主链上有3个碳的C5H12O2的二元醇必须是 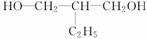 或
或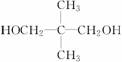 两种,主链上有4个碳的C5H12O2其支链中有一个C,即只能是
两种,主链上有4个碳的C5H12O2其支链中有一个C,即只能是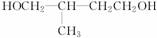 一种结构。
一种结构。
答案:D
12.(15分)中国人向来喜欢吉利,如第29届奥运会开幕定在--2008年8月8日8时。在有机化学中就有这样一个“吉利分子C8H8O8”,它与08年的奥运会同样有着引人注目的数字特征。“吉利分子C8H8O8”可以通过如图转化关系制得:
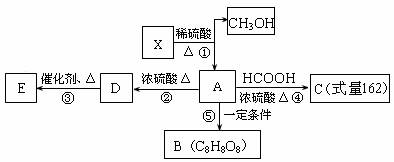
已知:①X的相对分子质量小于180,其中氧的质量分数约为49.4%;1molX在稀硫酸中发生水解反应生成2mol甲醇和1molA;X中没有支链。②E为高分子化合物;③B为环状结构。 试根据以上信息回答下列问题:
试根据以上信息回答下列问题:
 (1)1个X分子中,可能含有 个氧原子,A中官能团的名称为
;
(1)1个X分子中,可能含有 个氧原子,A中官能团的名称为
;
 (2)②的反应类型为_____________,③的反应类型为
;
(2)②的反应类型为_____________,③的反应类型为
;
 (3)写出④的化学方程式__________________________________________;
(3)写出④的化学方程式__________________________________________;
 (4)符合条件的有机物B有 种结构,写出其中一种含六元环的B的结构简式____________;
(4)符合条件的有机物B有 种结构,写出其中一种含六元环的B的结构简式____________;
 (5)一定量的A物质与乙醇的混合物完全燃烧生成27g水和V LCO2(标准状况),则等物质的量该混合物完全燃烧消耗氧气的物质的量为_________。
(5)一定量的A物质与乙醇的混合物完全燃烧生成27g水和V LCO2(标准状况),则等物质的量该混合物完全燃烧消耗氧气的物质的量为_________。
11.(15分)某学校化学兴趣小组要证明如图A装置中产生的气体成分。请从下图中选择适当的装置(装置符合气密要求,加热装置等已略去;其他用品可自选,已知NH3与CuO在加热条件下发生如下反应:3CuO+2NH3 N2+3Cu+3H2O)。将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加的试剂的名称及作用。
N2+3Cu+3H2O)。将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加的试剂的名称及作用。
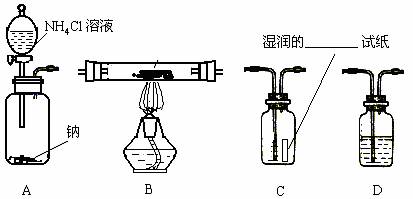
|
选用的仪器 |
加入试剂 |
加入试剂的作用 |
|
A |
Na与NH4Cl溶液 |
(此空格不必填写) |
|
|
|
|
|
|
|
检验是否有氢气生成 |
10.(15分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
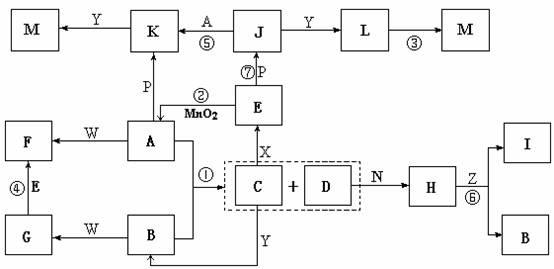
请按要求回答:
⑴写出C的电子式 ,I的化学式 ;
⑵反应③的化学方程式为 ;
⑶反应④的离子方程式为 ;
⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
9.(15分)某无色澄清溶液,可能含有较大量的Cu2+、Ba2+、SO42-、NO3-、I-、Cl-、H+、K+等离子中的两种或多种,做如下实验:
①取适量溶液加入少量Na2SO3后有气体产生,也有白色沉淀生成,再加盐酸沉淀不消失,过滤;
②在①的滤液中加入AgNO3溶液,又有白色沉淀生成,再加硝酸沉淀不消失。
回答下列问题:
(1)在第①步反应中生成无色易溶于水的气体是 ,生成的白色沉淀是 ;在第②步反应中生成的白色沉淀是 。
(2)由以上实验,可判断原溶液中一定含有的离子是 ,一定不含有的离子是 。
(3)设计一个简单实验,对可能含有的离子进一步确认。
8.某温度下,在体积为5L的密闭容器中,充入1molA气体,发生如下可逆反应:2A(g) B(g)+C(?);△H=akJ·mol-1 ,2min后反应达到平衡,A为0.4mol。下图是改变一个条件得到的反应速率(v)与时间(t)变化图。下列叙述正确的是 ( )
B(g)+C(?);△H=akJ·mol-1 ,2min后反应达到平衡,A为0.4mol。下图是改变一个条件得到的反应速率(v)与时间(t)变化图。下列叙述正确的是 ( )
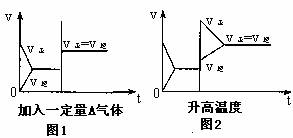
A.A物质的反应速率为0.04mol·(L·min)-1
B.充分反应后,该反应吸收热量为0.4akJ
C.C为非气体
D.若温度和容器体积不变,起始时B、C各0.5mol,则达到平衡时A的物质的量仍为0.4mol
7.下列图象能正确表示相关反应中产物物质的量(横、纵坐标单位:mol)的变化的是 ( )
A.图1:n(O2)=2mol时,高温下C和O2在密闭容器中的反应产物
B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
C.图3:n(HCl)=1mol时,K2CO3和HCl溶液在敞口容器反应生成的气体
D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
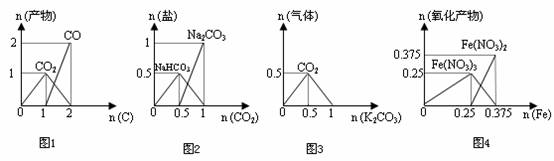
6.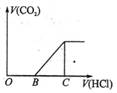 向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确的是(不计CO2的溶解) ( )
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确的是(不计CO2的溶解) ( )
A.若OB=0,则形成溶液M所发生的离子反应方程式为:
OH-+CO2=HCO3-
B.若OB=BC,则溶液M为Na2CO3溶液
C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
5.用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法正确的是 ( )
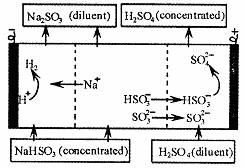
A.阳极区酸性减弱 B.阴极区电极反应式为:2H++2e-=H2↑
C.该过程主要是为了获得H2SO4 D.电解时两个电极都只能用惰性材料
4.下列叙述中,结论(事实)和对应的解释(事实)均不正确的是 ( )
A.金刚石的熔沸点高于晶体硅,因为C--C键能大于Si--Si键能
B.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
C.二氧化硅晶体中不存在简单的SiO2分子,因为其晶体是含有硅氧四面体的空间网状结构
D.分子空间构型为正四面体结构的分子中化学键的键角不一定是109028’,因为键角还有可能为600
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com