
题目列表(包括答案和解析)
15.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O  Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是
( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
解析:充电时为电解池,阳极Ni(OH)2发生氧化反应,A正确;充电时,电能转化为化学能,B错误;放电时负极为Cd,反应为Cd-2e-+2OH-===Cd(OH)2,故c(OH-)减小,pH减小,C错误;放电时,阴离子向负极移动,D错误.
答案:A
14.(2009·安徽蚌埠质检)下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
( )
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是正极
解析:A项中失电子多少不能说明失电子难易,例如Al与Na;B项中甲的阳离子氧化性强,则甲的还原性弱;C项正确;D项中甲作正极,则甲不如乙活泼.
答案:C
13.如图所示,下列叙述正确的是
( )
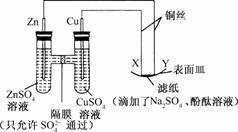
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
解析:图中左边装置是以Zn、Cu为电极的原电池装置,该电池中,Zn极为负极,Cu极为正极,而右边为电解池,根据连接情况可以推知,X为阳极,发生氧化反应,Y为阴极,发生还原反应,两极的电极反应式分别为X:4OH--4e-===2H2O+O2↑,Y:2H++2e-===H2↑,从而可得出答案应为A.
答案:A
12.铁锈的成分中含有铁的氧化物、铁的氢氧化物.研究证明,铁器的生锈与大气中的氧气、水蒸气有关.下列做法中最有利于减缓铁器生锈的是
( )
A.铁锅用完后用水刷洗干净其表面的油污
B.久置不用的铁刀涂抹凡士林在空气中保存
C.将铁壶盛水后保存
D.铁勺、铁铲放在阴湿处保存
解析:铁锅表面的油污用水刷洗掉后,铁直接与空气接触,而且铁锅刷洗后,表面有水,极易生锈;铁刀用凡士林涂抹后,使Fe与空气隔绝,可以减缓其生锈;铁器接触水,或在潮湿的空气中容易发生电化学腐蚀而生锈.
答案:B
11.由化学能转变的热能或电能仍然是人类使用的主要能源.根据下图所示的装置,判断下列说法不正确的是
( )
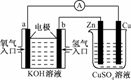
A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e-===2H2O
D.该装置中a极为正极,发生氧化反应
解析:该装置的左边是燃料电池,右边是电解池.a极为正极,发生还原反应;Cu极与电源正极连接,故为阳极;当铜片溶解了12.8 g时,失去电子12.8 g÷64 g/mol×2=0.4 mol,于是a极上O2得到电子也是0.4 mol,则消耗O2的物质的量是0.1 mol,在标准状况下的体积为2.24 L.
答案:D
10.金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是
( )
(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
解析:阳极发生氧化反应,A错误;电解过程中,阳极Zn、Fe、Ni溶解,阴极只有Ni析出,两电极质量的改变不等,B错误;电解液中除Zn2+、Fe2+外,还有Ni2+,C错误;阳极Ni、Zn、Fe溶解后,Cu、Pt沉积下来成为阳极泥,D正确.
答案:D
9.如下图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为
( )
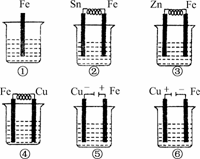
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
解析:②③④形成原电池,⑤⑥是电解池反应,金属被腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池的正极>电解池的阴极.
答案:C
8.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-12H2O
负极反应:C6H12O6+6H2O-24e-6CO2↑+24H+
则有关该电池的下列说法正确的是
( )
A.该电池的工作环境是高温条件
B.作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原
C.该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等
D.该电池的总反应为C6H12O6+6O26CO2+6H2O
解析:题目中指出“条件温和”,所以选项A是错误的;选项B中作为正极的葡萄糖(C6H12O6)在变化中失去电子,被氧化,所以错误;选项C中硝酸不可以作电解质溶液,浓硫酸与有机物会发生脱水等.把正极和负极的反应相加可以得出该电池的总反应为C6H12O6+6O26CO2+6H2O.
答案:D
7.为使反应:Cu+2H2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池
B.用铜片作电极,外接直流电源电解硫酸铜溶液
C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解稀硫酸
解析:选项A不能构成原电池,不发生反应,A错;B选项相当于精炼铜,B错;D项发生反应是Cu+2H+===Cu2++H2↑,故D错;C选项电解时,阳极Cu发生氧化反应,阴极上水电离出的H+发生还原反应,故反应为Cu+2H2O===Cu(OH)2+H2↑,所以正确答案C.
答案:C
6.用石墨做电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况
( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
解析:电解CuSO4的总反应方程式为 2CuSO4+2H2O2Cu+O2↑+2H2SO4,故从溶液中析出的物质是Cu和O2,每放出1 mol O2即析出2 mol Cu,Cu与O的物质的量之比为1∶1,所以,加入CuO可使溶液恢复原状.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com