
题目列表(包括答案和解析)
9.下列各组物质汽化或熔化时,所克服的粒子间的作用力,属于同种类型的是
( )
A.碘和干冰的升华
B.二氧化硅和生石灰的熔化
C.氯化钠和铁的熔化
D.苯和乙烷的蒸发
解析:A和D中物质的升华和蒸发,所克服的均为分子间作用力,而B中SiO2熔化克服的是共价键,生石灰熔化克服的是离子键,C中NaCl熔化克服的离子键,铁熔化克服的是金属键.
答案:AD
8.下列关于元素的叙述正确的是
( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.由非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
解析:金属元素与非金属元素一般形成离子键,非金属元素与非金属元素一般形成共价键,但AlCl3为共价化合物,铵盐为离子化合物,A正确;不带电的微粒质子数与核外电子数都相等,所以还可以是分子,B错;第六周期含有32种元素,C错;在PCl5中P原子最外层电子数是10,D错.
答案:A
7.下列叙述正确的是
( )
A.阳离子一定是金属离子,阴离子一定只含非金属元素
B.某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C.阴、阳离子相互作用后不一定形成离子化合物
D.离子化合物一定都溶于水
解析:阳离子不一定是金属离子如NH,A错;B也错,如FeCl2、FeCl3;离子化合物不一定都溶于水如BaSO4等,D错.
答案:C
6.(2009·泰安高三质量检测)由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20.则有关X的下列说法中正确的是
( )
A.X中阳离子和阴离子个数不一定相等
B.X中一定有离子键,一定不含共价键
C.若X只含两种元素,则这两种元素可在同一周期也可在同一主族
D.X中阳离子半径一定大于阴离子半径
解析:选项A,如Na2O中的阳离子和阴离子个数不等,而NaF中的阳离子和阴离子个数相等.选项B,如NH4F中含有离子键,但也含有共价键.选项C,若X只含有两种元素,则这两种元素一定在不同周期.选项D,在Na2O中,r(Na+)<r(O2-).
答案:A
5.下列有关物质结构的说法正确的是
( )
A.共价化合物中各原子最外层都一定满足8电子结构
B.BaO2晶体中阳离子与阴离子数目之比为1∶2
C.H2O是一种非常稳定的化合物,这是由于氢键所致
D.在反应2Na2O2+2H2O===4NaOH+O2↑,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成
解析:共价化合物H2O、BeCl2中H和Be两原子最外层均不是8电子结构,选项A错;BaO2晶体中阳离子是Ba2+,阴离子是O,两者的物质的量之比为1∶1,选项B错;选项C中水非常稳定的原因是氢氧键键能比较大.
答案:D
4.下列哪一组元素的原子间反应容易形成离子键
( )
|
原子 |
a |
b |
c |
d |
e |
f |
g |
|
M层电子数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
A.a和c B.a和f
C.d和g D.b和g
解析:由原子a-g的M层电子数可知,M层即为原子的最外层,元素a-g均为第三周期元素.a、b均为活泼的金属元素,f、g均为活泼的非金属元素,所以a与f、b与g形成的化学键为离子键.
答案:BD
3.(2010·德州调研)“氢原子失去电子后,剩余由1个质子构成的核,即氢离子.氢离子是‘裸露’的质子,半径很小,易被水分子吸引生成水合氢离子,通常用H3O+表示.”下列是某同学对这段文字的理解:
①氢离子都是裸露的质子 ②H失去电子变成裸露的质子 ③1 molH3O+含10×6.02×1023个电子 ④电子数相等、原子总数相等的粒子互为等电子体,等电子体的结构和性质相似,由此可推知H3O+呈正三角形 ⑤H3O+含极性共价键,不含非极性共价键.
其中不正确的是
( )
A.②③ B.②⑤
C.①④ D.③⑤
解析:氢原子包括氕、氘、氚,只有氕原子(没有中子)失去电子后变成裸露的质子;H3O+与NH3的原子数和电子数都相等,互为等电子体,所以H3O+呈三角锥形,H3O+中3个氢与氧形成极性共价键.
答案:C
2.(2009·徐州质检)固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是
( )
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.NH5固体投入少量水中,可产生两种气体
D.1 molNH5中含有5 molNH键
解析:所有原子的最外层都符合相应稀有气体原子的最外电子层结构,所以形成的是离子化合物,由NH和H-组成.A中NH含有共价键,NH和H-形成离子键;B中NH5是离子晶体,熔沸点高于氨气;C中NH5固体投入少量水中生成氨气和氢气.D中1 molNH5中含有4 molNH键.
答案:D
1.(2009·深圳高三调研)下列物质中,既含有离子键,又含有共价键的是
( )
A.MgCl2 B.Na2O2
C.Na2O D.Al2O3
解析:MgCl2、Na2O和Al2O3都只含有离子键;Na2O2中含有过氧根离子,过氧根离子中含有OO键,属于非极性共价键.
答案:B
22.(2009·日照模拟)(9分)已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:
(1)A的元素符号为________,C的氢化物的化学式为________.
(2)为比较C与D的单质的氧化性强弱,可设计实验以证实,则该实验所依据的反应的化学方程式为______________________________________.
(3)1 molC的氢化物与足量C的氧化物反应,转移的电子的物质的量为________mol.
(4)已知E、G、F是均含有B元素的化合物,其有关转化关系如下:
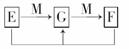
请写出E与F反应生成G的离子方程式____________________________.
解析:最外层与次外层电子数相等的短周期主族元素只有Be,即A为Be,另一种金属元素,只能是第三周期中的某金属元素,若为Na,则有一种元素原子最外层有8个电子,不符合题意,也不是Mg,否则与Be同主族,故只能是Al.最后推断可知:A为Be,B为Al,C为硫,D为氯.
(1)A为Be,S的氢化物为H2S.
(2)比较S与Cl的非金属性强弱,可利用Cl2通入氢硫酸中将硫置换出来或利用二者与变价金属铁作用时所得产物中Fe元素的价态来比较.
(3)2H2S+SO2===3S↓+2H2O,1 molH2S完全反应转移2 mol电子.
(4)符合条件的转化可为
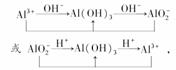
不管是哪个转化关系,E与F反应的离子反应均为Al3++3AlO+6H2O===4Al(OH)3↓.
答案:(1)Be H2S
(2)Fe+SFeS,2Fe+3Cl22FeCl3
(或H2S+Cl2===S↓+2HCl)
(3)2
(4)Al3++3AlO+6H2O===4Al(OH)3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com