
题目列表(包括答案和解析)
对“离子反应的本质是反应物的某些离子浓度的减小”这句话的深刻理解应是因某些离子发生了化学反应而造成离子浓度的减小,不能简单地认为减小就行,因为加水稀释的离子浓度肯定要减小,但绝不是发生了离子反应。
3.在白磷分子中,每个磷原子以 键与另外的 个磷原子相结合成 结构,键角为 。如果把一个白磷分子的每一个p--p都打开插入一个氧原子,则一共可结合 个氧原子,这样得到化合物的分子式为 。
答案: 3.共价;三;正四面体;60°;6P4O6白磷的分子式为P4,结构为 ,插入氧原子后为
,插入氧原子后为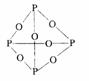
2.简答下列问题:
有机物多难溶于水,为什么乙醇和乙酸可与水互溶?
答案: 2.乙醇的醇羟基(C2H5)、乙酸的羧基(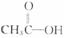 )均可和水(H-O-H)互相形成分子间的氢键,形成缔合分子,故可表现为互溶。
)均可和水(H-O-H)互相形成分子间的氢键,形成缔合分子,故可表现为互溶。
1.已知氯化铝的熔点为190℃(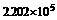 Pa),但它在180℃即开始升华。
Pa),但它在180℃即开始升华。
(1)氯化铝是 。(填“离子化合物…‘共价化合物”)
(2)在500K和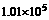 Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L
Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L ,试确定氯化铝在蒸气状态时的化学式为
。
,试确定氯化铝在蒸气状态时的化学式为
。
(3)无水氯化铝在空气中剧烈“发烟”,其原因是 。
(4)设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是 .
答案: 1.(1)共价化合物(2) (3)氯化铝与空气中的水发生水解反应产生HCl气体,HCl在空气中形成酸雾而“发烟”。 (4)在其熔融状态下,试验其是否导电,若不导电是共价化合物。
分析:根据氯化铝熔点低及在180℃时开始升华,判断其为共价化合物。氯化铝蒸气时相对分子质量即11.92×22.4=267,所以分子式为Al2Cl6。
13.单质硼有无定形和晶体两种,参考下列数据回答:
|
|
金刚石 |
晶体硅 |
晶体硼 |
|
熔点/K 沸点/K 莫氏硬度 |
>3823 5100 10 |
1683 2628 7.0 |
2573 2823 9.5 |
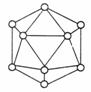 (1)晶体硼的晶体类型属于是 晶体。
(1)晶体硼的晶体类型属于是 晶体。
(2)已知晶体硼的基本结构单元是由B原子构成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个B原子。通过观察图形及推算,可知此结构单元是由于 个B原子构成,其中LB键间的夹角是 。
答案: 13.(1)原子 (2)12;60°根据B的熔沸点、硬度可知应为原子晶体,又根据图示可看出,每个面平均拥有的B原子数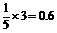 ,则20个面共有B原子数为0.6×20=12,B-B键夹角为60°。
,则20个面共有B原子数为0.6×20=12,B-B键夹角为60°。
综合能力溯练
12.参考下表中数据,回答有关问题:
|
物质 |
NaF |
NaCl |
NaBR |
NaI |
SiF |
SiCl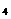 |
SiBr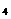 |
SiI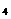 |
NaCl |
KCl |
RbCl |
RbCl |
SiCl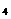 |
GeCl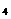 |
SnCl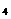 |
PbCl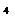 |
/ |
995 |
801 |
755 |
651 |
-90.2 |
-70.4 |
5.2 |
120.5 |
801 |
776 |
715 |
646 |
-70.4 |
-49.5 |
-36.2 |
-15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与 有关,随 增大, 减小,故熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物的熔点与 有关,随着 增大,则 增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应硅的卤化物熔点高得多,这与 有关,因为 ,故前者熔点远远高于后者。
答案: 12.(1)离子半径;离子半径;静电作用 (2)相对分子质量;相对分子质量;分子间作用力 (3)晶体类型;因钠的卤化物为离子晶体,其熔点取决于离子键的强弱,硅的卤化物为分子晶体,其熔点取决于分子间作用力,而离子键比分子间作用力强得多。
11.现有甲、乙、丙(如下图)三种晶体的晶胞:(甲中x处于晶胞的中心,PbCl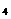 乙中a处于晶胞的中心),可推知:甲晶体中x与y的个数比是
,乙中a与b的个数比是
,丙晶胞中有
个c离子,有 个d离子。
乙中a处于晶胞的中心),可推知:甲晶体中x与y的个数比是
,乙中a与b的个数比是
,丙晶胞中有
个c离子,有 个d离子。
 答案: 11.
答案: 11. 处于晶胞中心的x或a为该晶胞单独占有,位于立方体顶点的粒子为8个立方体共有,位于立方体棱边的粒子为4个立方体共有,位于立方体面的粒子为2个立方体共有,所以
处于晶胞中心的x或a为该晶胞单独占有,位于立方体顶点的粒子为8个立方体共有,位于立方体棱边的粒子为4个立方体共有,位于立方体面的粒子为2个立方体共有,所以 ;丙晶胞中c离子为
;丙晶胞中c离子为 个;d离子为
个;d离子为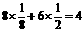 个
个
10.结合课本上干冰晶体图分析每个C02分子周围距离相等且最近的OQ分子数目为 ( )
A.6 B.8 C.10 D.12
答案: 10.D 根据干冰结构特点,干冰晶体是一种立方面心结构,每个CO2周围等距离最近的CO2有12个(同层4个,上层4个,下层4个)
9.下列化学式能表示物质分子的是 ( )
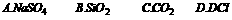
答案:a2SO4、KCl是离子晶体,构成粒子是离子;SiO2是原子晶体,构成粒子是原子;CO2是分子晶体,构成粒子是分子
8.下列各组物质中,熔点由高到低的是 ( )
A.HI、HBr、HCl、HF B.石英、食盐、干冰、钾
C.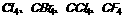 D.Li、Na、K、Rb
D.Li、Na、K、Rb
答案: 8.CD组成和结构相似的物质,随着相对分子质量的增加,熔、沸点依次升高,A选项HF可形成氢键,出现反常;B选项钾的熔点高于干冰;D选项碱金属随着相对分子质量增加,熔点依次降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com