
题目列表(包括答案和解析)
12.现有常温下的0.1 mol/L纯碱溶液.
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):______________________.为证明你的上述观点,请设计一个简单的实验,简述实验过程.
__________________________________________.
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO不超过其总量的10%.请你设计实验证明该同学的观点是否正确.______________________________________________.
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是________.
A.c(Na+)=2c(CO)
B.c(CO)>c(OH-)>c(HCO)>c(H2CO3)
C.c(CO)+c(HCO)=0.1 mol/L
D.c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
(4)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式________________.
解析:(1)Na2CO3属强碱弱酸盐,CO水解而显碱性,为证明这一点,可向Na2CO3溶液中滴入几滴酚酞,溶液显红色,然后加入过量CaCl2,若红色消失即证明是因CO所致.
(2)为了证明这点,可用pH试纸测常温下0.1 mol/L的纯碱溶液的pH,若pH<12,则c(H+)>10-12 mol/L,即c(OH-)<10-2 mol/L,所以可得出水解的CO数目不会超过其总量的10%.
(3)因CO水解,故c(Na+)>2c(CO),A错误;据CO的两步水解方程式便知c(CO)>c(OH-)>c(HCO)>c(H2CO3),B正确;C项由物料守恒知c(CO)+c(HCO)+c(H2CO3)=0.1 mol/L;D项属质子守恒.
(4)类比化学平衡常数的定义写出
Kh=.
答案:(1)CO+H2O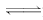
 HCO+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
(2)用pH试纸(或pH计)测常温下0.1 mol/L纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确
(3)BD (4)Kh=
11.已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
填写下列空白:
(1)若溶液中溶解了一种溶质,则该溶质是________(用化学式表示),上述四种离子浓度的大小顺序为________(填序号).
(2)若上述关系①是正确的,则溶液中的溶质为________________(用化学式表示);若上述关系②是正确的,则溶液中的溶质为________________(用化学式表示).
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH)________c(CH3COOH)(填“大于”、“小于”或“等于”,下同),混合前碱中c(OH-)和酸c(H+)的关系c(OH-)________c(H+).
解析:由题意知含四种离子的溶液可能是:①CH3COOH和CH3COONa ②CH3COONa ③CH3COONa和NaOH;因为CH3COONa溶液呈碱性,所以中性溶液一定是CH3COONa和少量CH3COOH的混合溶液.
答案:(1)CH3COONa ③
(2)CH3COONa、CH3COOH CH3COONa、NaOH
(3)小于 大于
10.下列叙述正确的是
( )
A.25℃时,将稀氨水逐滴加入到稀硫酸中,当pH=7时,2c(NH)=c(SO)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.在100℃条件下,pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合后溶液呈中性
D.欲使0.1 mol/L醋酸溶液中c(H+)/c(CH3COOH)值增大,可升温或加入盐酸
解析:A项,根据电荷守恒,c(NH)+c(H+)=2c(SO)+c(OH-),溶液呈中性,则c(NH)=2c(SO),不正确;B项,将pH=4的醋酸溶液稀释后,溶液中OH-浓度增大,故不正确;C项,100℃条件下,pH=3的盐酸c(H+)=10-3 mol/L, pH=11的NaOH溶液中c(OH-)=10-1 mol/L,等体积混合后溶液不呈中性,D项正确.
答案:D
9.已知一种c(H+)=1×10-3 mol/L的一元酸溶液和一种c(OH-)=1×10-3 mol/L的一元碱溶液等体积混合后溶液呈碱性,则生成的盐是
( )
A.强酸强碱盐 B.强酸弱碱盐
C.强碱弱酸盐 D.上述三种盐均可能
解析:当酸电离出的H+与碱电离出的OH-的浓度相等时,谁“弱”谁只有部分电离,谁才能保证是过量的,因混合后溶液呈碱性,故应为弱碱与强酸反应生成强酸弱碱盐,所以选B.
答案:B
8.向1 L 0.3 mol/L的NaOH溶液中缓慢通入8.8 g CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是
( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C.c(Na+)=c(HCO)+c(CO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)
解析:向1 L 0.3 mol/L的NaOH溶液中缓慢通入8.8 g CO2气体,完全反应后的溶液为Na2CO3和NaHCO3的混合溶液,所以选项A、B、C均不正确;选项D为电荷守恒,正确,选D.
答案:D
7.(2009·北京东城模拟)下列溶液中,粒子的物质的量浓度关系正确的是
( )
A.0.1 mol/L Na2CO3溶液:c(Na+)=2c(H2CO3)+2c(HCO)+2c(CO)
B.0.1 mol/L NH4Cl溶液:c(NH)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO)
解析:A项属于物料守恒,正确;B项因NH水解而消耗,应为c(NH)<c(Cl-),错误;C项中因混合溶液显酸性,故CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),错误;D项中因NaNO3属强酸强碱盐而不水解,所以c(Na+)=c(NO),正确.
答案:AD
6.(2009·南通高三调研考试)H2A为二元弱酸,则下列说法正确的是
( )
A.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
B.在等物质的量浓度的Na2A、NaHA两溶液中,前者pH大于后者
C.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+)
D.在Na2A溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
解析:选项A,在溶质物质的量相等的Na2A、NaHA两溶液中,由于A2-与HA-的水解程度不同,故阴离子总数不同,不正确;选项B,在等物质的量浓度的Na2A、NaHA两溶液中,由于A2-的水解程度比HA-的水解程度大,Na2A碱性较强,即pH前者大于后者;选项C,NaHA溶液中HA-可能电离程度大于水解程度,即溶液有可能呈酸性,如NaHSO3溶液,故不正确;选项D,表达的是电荷守恒,正确.
答案:BD
5.某漂白粉的成分为次氯酸钙和氯化钙(由氯气与石灰乳恰好反应制得),其溶液中离子浓度大小关系正确的是
( )
A.c(Cl-)>c(Ca2+)>c(ClO-)>c(H+)>c(OH-)
B.c(Cl-)=c(Ca2+)>c(ClO-)>c(OH-)>c(H+)
C.c(Cl-)+c(OH-)+c(ClO-)=c(Ca2+)+c(H+)
D.c(Ca2+)=2c(Cl-)+2c(ClO-)
解析:因Ca(ClO)2是强碱弱酸盐,溶液呈碱性,A错;由2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O知c(Cl-)=c(Ca2+),因ClO-水解,故c(Ca2+)>c(ClO-),来源于盐的离子浓度大于来源于水电离的离子浓度,故B对 ;依电荷守恒原理知C错;依物料守恒有c(Ca2+)=0.5[c(Cl-)+c(ClO-)+c(HClO)],D错.
答案:B
4.(2009·威海模拟)已知:HCN是一种弱酸.相同物质的量浓度的NaCN溶液和NaClO溶液相比,NaCN溶液的pH较大,则对同温同体积同浓度的HCN溶液和HClO溶液,下列说法正确的是
( )
A.酸的强弱:HCN>HClO
B.pH: HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)<c(ClO-)
解析:从题中可知NaCN溶液的pH较大,则CN-水解程度大,根据“越弱越水解”c(CN-)<c(ClO-),HCN的酸性弱于HClO的酸性,A项错误,D项正确;同条件下pH∶ HClO<HCN,B项错误;同体积同浓度的HCl和HClO具有相同的物质的量,中和NaOH的能力相同,C项错误.
答案:D
3.下列各组离子一定能大量共存的是
( )
A.在含有大量AlO的溶液中:NH、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO、NO
C.在pH=12的溶液中:NH、Na+、SO、Cl-
D.在c(H+)=0.1 mol/L的溶液中:K+、I-、Cl-、NO
解析:A项中AlO与H+不能共存,B项中各离子之间不反应,C项中pH=12时,OH-与NH不能共存,D项中酸性条件下,NO与H+、I-要发生氧化还原反应而不能共存,即选B.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com