
题目列表(包括答案和解析)
8.在下列叙述中,不符合氧族元素随核电荷数递增而引起性质递变规律的是
( )
A.它们单质的熔、沸点逐渐升高
B.单质的密度逐渐变大
C.它们的非金属性逐渐增强
D.它们的金属性逐渐增强
解析:氧族元素中按照氧、硫、硒、碲的顺序,元素的非金属性减弱,金属性增强,单质的熔、沸点逐渐升高,密度逐渐增大.
答案:C
7.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是
( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为X>Y>Z
解析:因X原子的最外层电子数是其电子层数的3倍,所以就能推出X元素即为O,而在短周期中能与O同主族的就只有S,即为Y,而Z原子的核外电子数比Y原子少1,也就不难得出Z元素即为P,最后本题的答案为A.
答案:A
6.在周期表前三周期中,a元素的气态氢化物与最高价氧化物对应水化物,在常温下能化合成一种化合物;b元素的气态氢化物与最高价氧化物对应水化物的浓溶液发生氧化还原反应;c元素的氧化物及对应水化物既能与强酸反应又能与强碱反应;d的最高价氧化物对应水化物是一种强酸,此四种元素的原子序数之和为
( )
A.25 B.48
C.53 D.62
解析:NH3+HNO3===NH4NO3,所以a为N;H2S+H2SO4(浓)===S↓+SO2↑+2H2O.则b为S;c的氧化物及对应水化物具有两性,c为Al;HClO4属强酸,故d为Cl,所以原子序数之和为7+16+13+17=53,选C.
答案:C
5.(2009·山东临沂质检)短周期元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻.下列说法不正确的是
( )
A.常见化合物E2D2与水反应生成D的单质,同时生成的溶液能使酚酞试液变红
B.C的氢化物与C的最高价氧化物的水化物反应得到的产物中既有离子键又有共价键
C.D与A、B、C、E分别结合均能形成两种或两种以上的化合物
D.五种元素的原子半径按A-E的顺序依次增大
解析:B的化合物种类繁多,数目庞大,B为碳元素.B、C、D同周期相邻,原子序数依次增大,则C、D分别为氮元素、氧元素.A、B、C、D、E都是短周期元素,它们的原子核外电子层数之和为10,且A、E同主族,则A、E分别为氢元素、钠元素.Na2O2与水反应生成O2和NaOH,NaOH能使酚酞试液变红.A中说法正确.C的氢化物与C的最高价氧化物的水化物反应得到的产物NH4NO3中既有离子键又有共价键,B中说法正确.氧元素与氢元素、碳元素、氮元素、钠元素结合能形成的化合物有H2O、H2O2、CO、CO2、NO、NO2、N2O5、Na2O、Na2O2等,C中说法正确.五种元素的原子半径从大到小的顺序为Na、C、N、O、H,D项符合题意.
答案:D
4.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是
( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.②③ B.③
C.①②③④ D.①②③
解析:由题意知:X、Y位于R、Z的下一周期,X、Y分别位于第m、n主族,R、Z分别位于第(8-m)、(8-n) 主族,a-m=b-n,即a-b=m-n,①错误;②③正确;最高价氧化物对应水化物碱性Y>X,④错误.
答案:A
3.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是
( )
A.乙元素的族序数比甲元素的族序数大
B.甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙
C.原子半径的大小:甲>乙
D.含乙元素的化合物数目比含甲或丙元素的化合物数目多
解析:因甲元素原子的最外层电子数是次外层电子数的2倍,所以甲元素为碳元素;乙元素原子的最外层电子数为次外层电子数的3倍,所以乙元素为氧元素;丙元素原子的K层和M层电子数之和与L层的电子数相同,所以丙元素为硫元素,由此可判断各选项的正误.
答案:D
2.(2009·广东五校联考)X、Y、Z、W均为短周期元素且核电荷数依次增加,X的最外层电子数是内层电子总数的3倍,Y原子最外层只有一个电子,Z与X的核电荷数之比为3∶2,W原子的最外层电子数比次外层电子总数少1.下列有关叙述不正确的是
( )
A.最高价氧化物对应水化物的碱性:YOH>Z(OH)2
B.氢化物的沸点:HW<H2X
C.X、Y两元素形成的离子化合物中阴、阳离子个数比一定为1∶2
D.W的最高价氧化物对应水化物为HWO3
解析:据题意知,X为O,Y为Na,Z为Mg,W为Cl.故碱性:NaOH>Mg(OH)2,A正确;因H2O分子中含氢键,故沸点:HCl<H2O,B正确;O与Na可形成化合物Na2O,Na2O2,二者晶体中阴、阳离子数之比均为1∶2,C正确;氯元素的最高价氧化物对应水化物为HClO4,D错误.
答案:D
1. 下列排列顺序正确的是
( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④
C.①④ D.②③
解析:①中因非金属性F>O>S,故稳定性HF>H2O>H2S;
②中三种元素的位置为
 ,故原子半径Na>Mg>O;
,故原子半径Na>Mg>O;
③中三种元素的位置为
 ,故酸性H3PO4<H2SO4<HClO4;
,故酸性H3PO4<H2SO4<HClO4;
④中酸性大小H2O<CH3COOH<HCl,故结合H+能力OH->CH3COO->Cl-.故选B.
答案:B
13.X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3.请回答下列问题:
(1)元素X的名称是________,丙分子的空间构型是________.
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________.丙在一定条件下转化为甲和乙的反应方程式为__________________________________.
(3)①化合物丁含X、Y、Z三种元素,0.1 mol/L丁溶液的pH为1,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号).
a.只含共价键
b.只含离子键
c.既含离子键,又含共价键
②常温下,戊的水溶液的pH________7(填“<”“=”或“>”),其原因是
______________________________________(用离子方程式表示).
解析:X、Y、Z分别为H、O、N,甲、乙、丙分别为NO、H2O、NH3,NH3的空间构型为三角锥形.丁为HNO3,戊为NH4NO3,在NH4NO3晶体中既含离子键,又含极性共价键.NH4NO3水解显酸性.
答案:(1)氢 三角锥形
(2)NO 4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)①c ②< NH+H2ONH3·H2O+H+
12.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
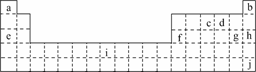
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图________.
(2)以上元素形成的金属单质中,熔点最低的是________(填元素符号).
(3)NH3·H2O的电离方程式为NH3·H2ONH+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是下图中的________.(填序号)

(4)1906年的诺贝尔化学奖授予为制备F2作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是________.(填写字母)
(5)利用稀有气体化合物,人们实现了许多制备实验上的突破.如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:
__________________________________.
解析:(1)Fe的质子数为26,最外层有2个电子,所以原子结构示意图为 .
.
(2)上述元素中金属元素有Na、Al、Fe,Na的熔点最低.
(3)据NH3·H2O的电离方程式NH3·H2ONH+OH-,可以看出乙更合理.
(4)人们首先用Xe与F2发生反应制取了一系列的氙的氟化物.
(5)因反应物和产物已告诉,再结合得失电子守恒即可配平该化学方程式.
答案:(1) 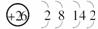 (2)Na (3)乙 (4)j
(2)Na (3)乙 (4)j
(5)3NaBrO3+XeO3===3NaBrO4+Xe
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com