
题目列表(包括答案和解析)
4.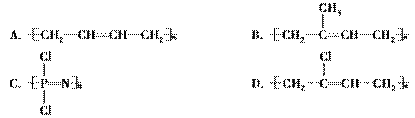 (2009·滨州质检)随着工业的高速发展,橡胶的产量和性能已不能满足工业生产的需要,近年来,人们合成了一种无机耐火橡胶,它的结构应是( )
(2009·滨州质检)随着工业的高速发展,橡胶的产量和性能已不能满足工业生产的需要,近年来,人们合成了一种无机耐火橡胶,它的结构应是( )
?
解析:无机二字则为解题突破口,所以选C,因为A、B、D均为有机物。
 答案:C
答案:C
3.酚醛树脂可用苯酚和甲醛反应制得。实验室制备酚醛树脂时,在酸性条件下,苯酚过量时,制得的酚醛树脂若不易取出,则可趁热时加入一些乙醇来取出树脂;在碱性条件下,苯酚过量时,若酚醛树脂不易取出,用加热或加溶剂的方法都很难将树脂取出。在上述两种情况下,下列有关叙述正确的是( )
A.酸性条件制得的是线型酚醛树脂,碱性条件制得的是网状结构酚醛树脂
B.酸性条件制得的是体型酚醛树脂,碱性条件制得的是线型酚醛树脂
C.两种条件下制得的都是线型酚醛树脂
D.两种条件下制得的都是网状结构酚醛树脂
解析:线型结构的有机高分子能溶解在适当溶剂里,在酸性条件下,制得的酚醛树脂能溶在酒精里,说明是线型的;体型(网状)结构的有机高分子不易溶解,只是有一定程度的胀大,故在碱性条件下,得到的是体型的。
答案:A
2.据中央电视台2008年5月1日报道,在奥运圣火登顶珠峰的过程中,我国人员承诺:“只留下脚印,不留下使环境受到影响的物质。”保护环境就是保护人类自己,从保护
环境的角度出发,目前最有发展前景的一次性餐具是( )
A.瓷器餐具 B.淀粉餐具 C.塑料餐具 D.不锈钢餐具
解析:A.B.D显然是甲基上的H被Cl取代,A、C、D均可使环境造成影响,淀粉餐具可被生物降解。
答案:B
1.下列物质中,不属于合成材料的是( )
A.塑料 B.人造纤维 C.合成橡胶 D.黏合剂
解析:塑料无天然品种,橡胶有天然和合成的品种,黏合剂也是合成高分子材料。
答案:B
12.(2010·山师附中月考题)由于燃料电池汽车,尤其氢燃料电池汽车可以实现零污染排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,燃料电池汽车成为近年来汽车企业关注的焦点。为了获得竞争优势,各国纷纷出台政策,加速推进燃料电池关键技术的研发。燃料电池的燃料有氢气、甲醇、汽油等。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)===2H2O(l);ΔH=-285 kJ·mol-1①
CH3OH(l)+O2(g)===CO2(g)+2H2O(l);ΔH=-726.0 kJ·mol-1②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:___________________________。
(2)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇-空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①电池正极发生的反应是_______________________________________;
负极发生的反应是____________________________________________。
②在稀土金属氧化物的固体电解质中,O2-的移动方向是________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者却要花费大量的精力研究甲醇燃料汽车。主要原因是:___________________________________。
解析:(1)热化学方程式①×-②可得合成甲醇的热化学方程式为:CO2(g)+3H2(g)===CH3OH(l)+H2O(l);ΔH=298.5 kJ·mol-1。
(2)该燃料电池的正极是氧气得电子,而负极则是甲醇失电子。由于正极氧气得电子生成O2-,而负极O2-参与电极反应,故在固体电解质中O2-从正极流向负极;燃料电池中使用的燃料不经过燃烧而直接转化为电能,能量转化率高。
技巧点拨:由已知的几个热化学方程式求另外的热化学方程式,往往需要应用盖斯定律对已知的几个热化学方程式进行变形,然后进行加减处理。
答案:(1)CO2(g)+3H2(g)===CH3OH(l)+H2O(l);ΔH=298.5 kJ·mol-1
(2)①O2+4e-===2O2- CH3OH+3O2--6e-===CO2+2H2O
②从正极流向负极 ③燃料电池的能量转化率高
11.(2010·北京-黄冈预测卷一)中国科学院一院士说:“在未来一个较短的时期内,最有潜力替代石油的能源是生物质能源。”下图就是生物质能源的生成与利用的循环图,下列有关说法不可能正确的是( )

A.生物质能源最终来源于太阳能
B.生物质能源可以再生
C.图中③的能量转化方式为化学能转化为热能,热能再转化为电能
D.乙醇可以认为是一种生物质能源,其燃烧的热化学方程式为:C2H5OH+3O2===2CO2+3H2O;ΔH=-1 366.8 kJ/mol
解析:热化学方程式中的各物质必须标注状态。
答案:D
10.(2010·山东省实验中学1月考题)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g);ΔH1=+64.39 kJ·mol-1
②2H2O2(l)===2H2O(l)+O2(g);ΔH2=-196.46 kJ·mol-1
③H2(g)+1/2O2(g)===H2O(l);ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式可以表示为( )
A.Cu+H2O2+2H+===Cu2++2H2O;ΔH=-319.68 kJ·mol-1
B.Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l);ΔH=-319.68 kJ·mol-1
C.1/2Cu(s)+1/2H2O2(l)+H+(aq)===1/2Cu2+(aq)+H2O(l);ΔH=+319.68 kJ·mol-1
D.Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l);ΔH=-419.68 kJ·mol-1
解析:热化学方程式正误判断方法:一看是否配平,二看是否标明物质的状态,三看能量变化是否与计量数相对应,即ΔH与反应物的物质的量是否对应,三者缺一不可。根据盖斯定律,①+×②+③得:Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l);ΔH=ΔH1+1/2ΔH2+ΔH3=-319.68 kJ·mol-1。
答案:B
9.(2010·北京-黄冈预测卷二)据《中国青年报》2009年11月26日报道,国务院常务会议决定,到2020年我国单位GDP(国内生产总值)二氧化碳排放量将比2005年下降40%-45%。下列措施不利于实现该目标的是( )
A.大力发展可再生能源
B.积极推进核电建设
C.倡导植树造林,加强森林管理,提高森林覆盖率
D.大炼钢铁,提高铁、铝、铜等金属的产量,以保证国内生产总值的提升
解析:可再生能源、核电的使用可以减少热电的使用,从而降低对煤炭的依赖;森林可以吸收二氧化碳;铁、铝、铜等金属的冶炼属于高耗能行业,大力发展这些行业会增加碳的排放。
答案:D
8.(2010·原创题)写出下列反应的离子方程式
(1)用胃舒平治疗胃酸过多。
(2)用双氧水将某酸性溶液中的Fe2+转化成Fe3+。
(3)水玻璃(Na2SiO3的水溶液)与NH4Cl溶液混合制各种模型。
(4)乙烯使酸性高锰酸钾溶液褪色(氧化产物为气体)。
(5)用食醋除水壶中的水垢(CaCO3)。
(6)向含0.1 mol NaAlO2的溶液中滴加20 mL 8 mol/L的HCl(aq)的离子方程式为________________________________________________________________________。
(7)含0.1 mol Ca(HCO3)2的溶液中逐滴加入100 mL 1.5 mol/L的NaOH溶液的离子方程式为___________________________________________________________________。
(8)向Mg(HCO3)2溶液中滴加过量的NaOH溶液,离子反应方程式为________________________________________________________________________。
(9)向含0.1 mol FeI2的溶液中滴加含0.12 mol Br2的溴水,离子反应方程式为________________________________________________________________________。
解析:(1)胃舒平主要成分Al(OH)3,胃酸主要成分HCl。
(2)H2O2将Fe2+氧化,还原产物是H2O。
(3)SiO32-与NH4+发生双水解反应生成H2SiO3沉淀。
(4)C2H4被氧化成CO2,碳元素从-2价升高到+4价。
(5)CH3COOH与CaCO3反应,生成的醋酸钙是强电解质且可溶。
(6)n(AlO2-)=0.1 mol,n(H+)=0.16 mol,反应过程可认为是①AlO2-+H++H2O===Al(OH)3↓,
②Al(OH)3+3H+===Al3++3H2O,所以该反应离子方程式为:5AlO2-+8H++2H2O===Al3++4Al(OH)3。
(7)该反应过程可认为:Ca2++HCO3-+OH-===CaCO3↓+H2O,HCO3-+OH-===CO32-+H2O。所以该反应离子方程式为:2Ca2++3HCO3-+3OH-===2CaCO3↓+3H2O+CO32-。
(8)注意MgCO3的溶解度比Mg(OH)2的大,因而该反应离子方程式为:Mg2+
+2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O。
(9)因为还原性I->Fe2+,且Br2也能氧化Fe2+。首先I-全部被氧化后,Br2再氧化
Fe2+,该反应离子方程式为:2Fe2++10I-+6Br2===2Fe3++5I2+12Br-。
答案:(1)Al(OH)3+3H+===Al3++3H2O
(2)H2O2+2Fe2++2H+===2Fe3++2H2O
(3)SiO32-+2NH4++2H2O===H2SiO3↓+2NH3·H2O
(4)5C2H4+12MnO4-+36H+===12Mn2++10CO2+28H2O
(5)2CH3COOH+CaCO3===2CH3COO-+Ca2++H2O+CO2↑
(6)5AlO2-+8H++2H2O===Al3++4Al(OH3)↓
(7)2Ca2++3HCO3-+3OH-===2CaCO3+3H2O+CO32-
(8)Mg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O
(9)2Fe2++10I-+6Br2===2Fe3++5I2+12Br-
考点3 化学反应中能量变化规律、热化学方程式的书写及正误判断
7.(2009·全国Ⅰ,8)下列表示溶液中发生反应的化学方程式错误的是( )
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH===2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4===Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
解析:在高考选择题中很少出现对化学方程式的正误判断,但这次也给我们提了个醒,
在高考备考的过程中也应注意此类问题的训练。对选项A和C考生应该很熟悉,其是正确的;选项B考查的是甲酸盐中羧基被强氧化剂氧化,但反应前溶液的介质是强碱KOH,因此HCOOK的最终氧化产物不可能是CO2,应是碳酸盐,B错;Cr2O72-在教材中也多次出现,如废水处理过程中的Cr2O72-,因此同学们应该像关注MnO4-一样关注
Cr2O72-,在酸性条件下Cr2O72-是强氧化剂,其还原产物为Cr3+,本题中Fe2+被氧化生成Fe3+,该化学反应方程式符合“三大守恒”,因此是正确的。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com