
题目列表(包括答案和解析)
7. 实验室要配制50 g溶质质量分数为20%的硝酸钾溶液,现有25 g溶质质量分数为40%的硝酸钾溶液、20 g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填入下表
|
|
配制方案(只要说明配制时所需的各种药品及用量即可) |
|
方案一 |
|
|
方案二 |
|
|
方案三 |
|
6.右图是A、B两种物质的溶解度曲线,根据图示回答下列问题:
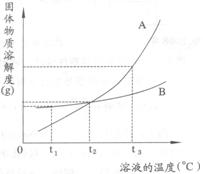 (1)t1℃时,向两只盛有100g水的烧杯中,分别加入A、B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是___________溶液(填“A”或“B””)。
(1)t1℃时,向两只盛有100g水的烧杯中,分别加入A、B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是___________溶液(填“A”或“B””)。
(2)t2℃时,欲配制等质量的A、B两种物质的饱和溶液,所需水的质量关系是A________B。 (填写“>”、“<”或“=”,下同)
(3)将t2℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A______B。
(4)将t2℃的A、B两种物质的饱和溶液各200g,升温至t1℃,欲使它们仍为饱和溶液,若不改变溶剂质量,所需加入固体溶质的质量关系是A_______B。
5.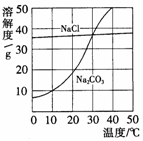 右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
(1)当温度为10℃时,碳酸钠的溶解度为 ;
(2)当温度 时,氯化钠的溶解度大于碳酸钠的溶解度;
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。
请你解释原因:“夏天晒盐” ;
“冬天捞碱” 。
请你解释原因:“夏天晒盐” 。
4.现有60℃的饱和NaCl溶液,与该溶液有关的量有:①水的质量;②溶液中溶质NaCl的质量;③NaCl的质量分数;④60℃时NaCl的溶解度:⑤溶液的质量。用序号填空:
(1)将该饱和溶液稀释,不变的量有: ;
(2)将该饱和溶液降温至20℃,一定变化的量有 。
提升题:
3.用氯化钠配制l00g溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是
(A)①②③④ (B)⑤②④①
(C)①③⑤②④① (D)①③⑥⑤②④①
2.下列关于溶液的说法错误的是 ( )
A.饱和溶液析出晶体后,其溶质的质量分数可能不变
B.在溶液里进行的化学反应,通常比较快
C.同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D.不饱和溶液转化为饱和溶液,溶质质量分数可能不变
1.下列物质中既存在离子又存在分子的是 ( )
A.氯化钠晶体 B.金刚石
C.氯化钠溶液 D.液氧
3.(3)溶解度曲线的应用
①判断某种物质在不同温度下的溶解度大小。
②比较不同物质在同一温度下溶解度的大小。
③判断物质溶解度受温度影响变化的趋势。
④如何通过改变温度和增加溶质,将不饱和溶液变为饱和溶液。
⑤如何通过改变温度或蒸发溶剂,使溶质从溶液中析出
冲关训练:
基础题:
2.判断溶液是否饱和的方法:
一般说,要确定某一溶液是否饱和,只要看在一定温度下有没有不能继续溶解的剩余溶质存在,如有,且溶质的质量不再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶液。
(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
(2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
精题导解:
考点1:溶液
例1:关于溶液的叙述正确的是
A溶液都是无色的 B饱和溶液一定是浓溶液
C糖水的溶质是水 D医用生理盐水是溶液
解析:溶液是均一、稳定的混合物,因此并不是说溶液一定是无色的,因此A是错误的;饱和溶液并不一定是浓溶液,但是同一温度下,同一种溶质的饱和溶液一定比不饱和溶液要浓,故B错误;糖水是蔗糖与水的混合物,根据溶质、溶剂的判定方法,糖水中的容只是蔗糖,因此C错误。因此叙述正确的是D。
答案:D
点拨:溶液中溶质、溶剂的判定应根据判定方法里确定,固体与液体混溶形成的溶液,古体是溶质,液体是溶剂。
考点二:饱和溶液与不饱和溶液之间的转化
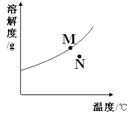 例2:右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)
例2:右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
 解析:根据题中的图示来看,A物质的溶解度受温度的影响很大,从M到N,可以采用升高温度再增加溶剂的方法;而从N到M,可以采用升温再将其蒸发掉部分,因此,正确的是D。
解析:根据题中的图示来看,A物质的溶解度受温度的影响很大,从M到N,可以采用升高温度再增加溶剂的方法;而从N到M,可以采用升温再将其蒸发掉部分,因此,正确的是D。
答案:D
点拨:在解答此题是需要注意的是,在选择方法上要考虑到温度的改变。
考点三:溶解度曲线的意义
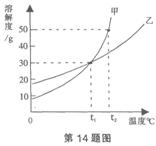
例3:甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
A.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全溶解
B.t2℃时,甲和乙的饱和溶液中溶质的质量分数相等
C.t2℃时,在lO0g水中放入60g甲,所得溶液溶质的质量分数为37.5%
D.t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
解析:本题注重考查对溶解度曲线理解。在t1℃时,甲、乙两种物质的溶解度相同,均为30g,因此甲、乙各30g分别加入70g水中并不能恰好完全溶解,而是都剩余了一部分,因此A项错误。t2℃时,甲和乙的溶解度不相同,因此二者的饱和溶液中溶质的质量分数不相同,故B错误。t2℃时,甲的溶解度为50g,把60g甲物质放入100g水中会形成150g的饱和溶液,此时其溶质质量分数为33.3%,故C错误。根据甲、乙的溶解度曲线的示意图来看,t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,首先饱和的是甲物质,因此D是正确的。
点拨:解答本题需明确掌握溶解度曲线的意义及其变化的规律。要分清曲线上的点、曲线上方和下方的点以及不同曲线的焦点的含义。
考点四:溶液的配制
例4:要配制100g 溶质质量分数为10%的氯化钠溶液,下列操作中正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
解析:在称量固体药品时,固体应放在干净的纸上或者时一定容器内,而不是直接放在托盘天平上。在量取液体时,视线要与量筒内凹液面的最低处保持水平。在对固体物质进行溶解时,应该用玻璃棒搅拌而不是温度计。因此正确答案为D。
答案:D
点拨:溶液配制是近几年来中考的热点之一,主要体现在溶液配制的步骤、方案、仪器的使用等方面。
方法指引:
1、溶液中溶质、溶剂的判定
(1)固体、气体溶于液体时,固体、气体是溶剂;
(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com