
12.在一定的温度下,将2 mol SO2和1 mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2 + O2(g)  2SO2(g) △H =-197 kJ·mol-1,当达到平衡状态时,下列说法中正确的是:
2SO2(g) △H =-197 kJ·mol-1,当达到平衡状态时,下列说法中正确的是:
A.生成SO3 2 mol B.放出197 kJ 的热量
C.O2有1 mol D.含有氧元素6 mol
11.下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多。
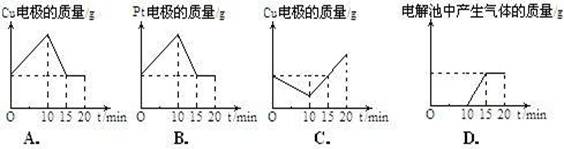
B.已知C(s)+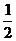 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ。
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ。
C.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0。若平衡后加入X,则上述反应的ΔH增大。
Z(g)+W(s) ΔH>0。若平衡后加入X,则上述反应的ΔH增大。
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -53.7kJ·mol-1 ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ。
10.下列事实不能用勒夏特列原理解释的是:
A.黄绿色的氯水光照后颜色变浅
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.温度过高对合成氨不利
D.溴水中有平衡:Br2+ H2O  HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
9.将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,
以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min。下列表示铜电
极、铂电极、电解池中产生气体的质量和电解时间的关系图正确的是:
8.电解饱和食盐水,当阴极附近有0.4 mol NaOH生成时,阳极放出:
A.0.2 mol H2 B.0.2 mol Cl2 C.0.4 mol H2 D.0.4 mol Cl2
7.有X、Y、Z、M四种金属,已知:M投入水中可与水剧烈反应,用X和Z作电极,稀硫酸作电解质溶液构成原电池时,Z为正极,Y和Z的离子共存于电解液中电解,阴极析出Y。则这四种金属的活动性由强到弱的顺序是:
A.X>Z>Y>M B.X>M>Z>Y C.M>Y>Z>X D.M>X>Z>Y
6.下列说法正确的是:
A.食物在常温下腐败是自发进行 B.凡是放热反应都是自发的
C.自发反应都是熵增大的反应 D.电解池的反应是属于自发反应
5.1g H2完全燃烧生成液态水放出a kJ的热量,下列热化学方程式正确的是:
A.H2 (g)+ 1/2 O 2(g)= H2O(l) △H = -a kJ.mol-1
B.2H2(g) + O2(g) = 2H2O(l) △H = -4a kJ.mol-1
C.2H2(g) + O2(g) = 2H2O(l) △H = +4a kJ.mol-1
D.H2(g) + 1/2 O2(g) = H2O(g) △H = -2a kJ.mol-1
4.在一定温度的定容密闭容器中,反应A2(g)+B2(g) 2AB(g)达到平衡状态的是:
2AB(g)达到平衡状态的是:
A.混合气体的密度不再改变
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.A2、B2、AB的分子数之比为1:1:2时
3.在中和热测定的实验中不需要用到的仪器是:
A.量筒 B.温度计 C.环形玻璃搅拌棒 D.天平
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com