
4.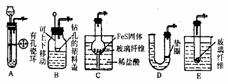 现有下列用品:仪器:单孔橡皮塞、双孔橡皮塞、球形干燥管、破底试管、U形管、塑料垫盖、烧杯、、铜丝、带活塞的导管等。药品:FeS固体、浓H2SO4、蒸馏水、浓盐酸、Na2S固体。试运用创造性思维,设计出尽可能多的简易的能随开随用、随关随停的H2S气体发生器。(画出装置图)
现有下列用品:仪器:单孔橡皮塞、双孔橡皮塞、球形干燥管、破底试管、U形管、塑料垫盖、烧杯、、铜丝、带活塞的导管等。药品:FeS固体、浓H2SO4、蒸馏水、浓盐酸、Na2S固体。试运用创造性思维,设计出尽可能多的简易的能随开随用、随关随停的H2S气体发生器。(画出装置图)
答案:
点拨:本题为开放性试题,以考查学生的创新能力,答案中的创新灵感请同学们细心口味和深刻体会。
[强化训练]
3.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
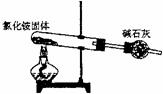
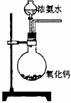


A B C D
答案:AC
点拨:A 中NH4Cl分解会产生NH3和HCl,但它们相遇化合又会在管口凝聚,故收集不到NH3;B 氧化钙易吸收浓氨水中的水,并放出大量的热,促进NH3的逸出,是理想方案;C 固体加热,试管口应略向下倾斜;D 浓氨水受热逸出,也是实验室制NH3的简便方法。选D
2.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下: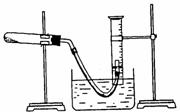 ①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
②装好实验装置。③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为bg。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。回答下列问题:
⑴如何检查装置的气密性?
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量简内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量简内外液面的高度相同?
(4)如果实验中得到的氧气体积是c L(25℃、1.0×105Pa)的,水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)=_____________
答案:(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③(3分)(3)慢慢将量筒下降
(4)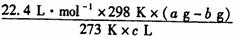
点拨:第(1)小题是考生熟悉的常用的“查漏”方法,用手握住试管,体温使导管在浸入水槽中的出口处冒出气泡,放开手后,有少量水吸入导管,表明不漏气。第(2)小题因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管。这一步操作与通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸。停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的。所以本小题的正确顺序是②①③。第(3)小题量筒应慢慢下移。第(4)利用恒压下的气体公式求得气体的物质的量和相对分子质量。
热点1:常见气体的制备
[考点阐释]
(1)掌握常见气体的实验室制法
(2)理解制备气体实验装置中各仪器的作用
(3)掌握气密性检查的方法,并能用文字准确的表达
(4)实验的安全防护
(5)尾气的吸收装置
[考察角度]
(1)气体发生装置
据反应物状态和反应条件选气体发生装置有如下几种:固体+固体气体;固体+液体气体;固体+液体气体或液体+液体气体
(2)气体的收集
排水法:不溶一水或微溶于水不与水发生反应气体的收集,优点是收集的气体纯度高,易判断是否收集满。向上排气法:不跟空气发生反应密度比空气大的气体的收集。向下排气法:不跟空气发生反应密度比空气大小的气体的收集。
(3)尾气吸收
点燃法:适用于CO、H2、CH4、C2H2、C2H4等。水吸收法:适用于HCl、HBr、NH3等。碱液吸收法:适用于SO2、CO2、NO2、H2S、Cl2等。
(4)气体的净化和干燥
|
需净化的气体(括号内为杂质) |
净化方法 |
|
H2(H2O、HCl) |
NaOH溶液、浓H2SO4或碱石灰 |
|
CO2(H2O、H2S) |
CuSO4溶液(或NaOH溶液)、浓H2SO4 |
|
O2(Cl2) |
NaOH溶液、浓H2SO4 |
|
NO(NO2) |
H2O、浓H2SO4 |
|
NH3(H2O) |
碱石灰 |
|
CO2(CO) |
灼热的CuO |
|
N2(O2) |
灼热的Cu |
|
CH4(C2H4) |
稀溴水、浓H2SO4 |
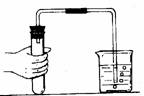 (5)装置气密性检查
(5)装置气密性检查
采用加热法或者采用加水法。如图装置气密性检查方法为:联接好制气装置,把导管的一端浸在水里,里面的空气受热膨胀,导管口有气泡冒出。移开手有水进入导管,在玻璃导管中形成一段水柱,观察水柱不下降,则装置气密性良好;反之则装置气密性不好。启普发生器的气密性检查方法为:关上启普发生器的开关3,在上部半球型漏斗中加入足量的水,观察1中水面不下降,则装置气密性良好;反之装置气密性不好。要注意若装置有多个开口时,检验前要作适当的处理,只留下一个开口,通过对装置内密封的一部分 气体的压强改变,观察产生的外部变化,达到检验装置气密性的目的。如果实验装置较复杂也可以考虑用分段检查的方法。
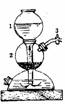 (6)常见气体制备方法
(6)常见气体制备方法
对常见气体如:O2、Cl2、NH3、H2、CO2、SO2、NO2、C2H2、C2H4、CH4、NO从反应原理、发生装置、收集装置、注意事项等几个方面进行认识归纳。
[方法指导]
要掌握常见气体的制备方法并在此基础上掌握实验室制备气体的一般步骤。
[考点突破]
(1)重点:典型气体的制备、净化和收集方法
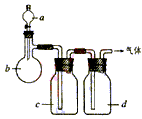 例:拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
例:拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
|
气体 |
a |
b |
c |
d |
|
C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
|
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
|
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
|
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
答案:(1)NO
(2)①C2H4 装置中没有温度计,无法控制反应温度
②Cl2 反应生成的Cl2被c中的NaOH溶液吸收了
③NH3 反应生成的NH3被c中的H2O吸收了
点拨:(1)用乙醇和浓硫酸制乙烯,温度控制很严,而装置中无温度计,显然不一定能制得乙烯;(2)MnO2和浓HCl共热可制得Cl2,但当通过NaOH溶液时,Cl2被吸收,因而最后也得不到Cl2;(3)饱和NH4Cl溶液与消石灰共热可以产生NH3,但通过H2O时,NH3也被吸收,最后仍然得不到NH3;(4)NO的制备和干燥、净化均合理,因此本题可以得到干燥、较纯净的气体的应该是NO。
归纳:考查典型气体的制备、净化和收集方法,不会单纯地考查实验室制备方法,需要以实验室制备方法为载体,综合运用所学的知识,进行归纳整理、知识迁移才能很好的解答
(2)难点:气密性检查
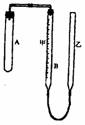 例:现有实验药品:一定质量的锌(分片状和粒状两种)、浓硫酸(密度1.84g.cm-3)、水。以及右图装置,图中量气管B是甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度(0-100mL),甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低,利用此装置可测定锌的相对原子质量。(设锌全部反应的气体不超过50mL)。回答下列问题:
例:现有实验药品:一定质量的锌(分片状和粒状两种)、浓硫酸(密度1.84g.cm-3)、水。以及右图装置,图中量气管B是甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度(0-100mL),甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低,利用此装置可测定锌的相对原子质量。(设锌全部反应的气体不超过50mL)。回答下列问题:
(1) 实验前为检查装置气密性,先将A、甲、乙三管固定,乙管中注入水,液面高于甲液面,静止片刻,___说明装置乞密性良好。
(2) 按图示装置实验,要保证不漏出氢气,应如何操作?
答案:(1)液面保持不变。(2)将A试管的胶塞打开,加适量水,再沿试管壁慢慢注入少量浓硫酸(1/3)振荡,将试管斜放把锌片(为什么不是锌粒?请思考)放在试管口内壁,塞上胶塞,把试管慢慢直立
点拨:该题(1)是对加水法检查装置气密性的考查,如果掌握了加水法检查装置气密性的原理,对该问回答是很容易的。(2)是在装置气密性良好的前提下,如何设计实验操作,使反应产生的氢气不会跑掉,是另一种形式的装置气密性问题,只要从锌和稀硫酸接触反应之前,塞好塞子展开想象,问题就容易解决了。
归纳:装置气密性的检查是高考命题的一个热点,解答时要注意对不同的装置检查的分析,搞清楚哪些需要小火加热、哪些需要用手捂、哪些需要加水;同时注意对气密性检查的规范叙述,很多同学都知道操作,但由于文字表述不清楚或者不规范导致失分。
(3)疑点:尾气吸收
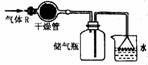 例:实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
例:实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
A、NO2 B、HCl C、CH4 D、NH3
答案:D
点拨:由气体的吸收装置可知该气体极易溶于水,由储气装置可判断气体密度,应比空气小,综合确定应为D选项。
归纳:从气体的密度、溶解性、气体的化学性质等综合考虑选择气体的收集方法和吸收剂
[例题剖析]
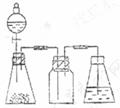
1.研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________________________。
(2)将SO2气体分别通入下列溶液中:
① 品红溶液,现象是_________________________________________________;
② 溴水溶液,现象是____________________________________________;
③ 硫化钠溶液,现象是______________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因_____________________;验证方法__________________________。
②原因_____________________;验证方法__________________________。
 ③原因_____________________;验证方法__________________________。
③原因_____________________;验证方法__________________________。
答案:(1) ①如图配置
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2) ①溶液褪色②溶液褪色③有浅黄色沉淀(或溶液变浑浊)
(3)①Na2SO3 变质 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2 ,溶液有白色沉淀生成,则证明该Na2SO3 固体变质
②不是浓硫酸 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸。
点拨:(1)①注意在装置中需考虑尾气吸收;②分液漏斗使用时要与大气相通,否则液体不能流下;
(2) SO2有漂白性、还原性、氧化性,①品红溶液褪色是SO2的漂白性,② 溴水溶液褪色是SO2的还原性,发生反应SO2+Br2+H2O=2HBr+H2SO4,③ 硫化钠溶液有浅黄色沉淀是SO2的氧化性,将S2-氧化成S。
(3)可分别从Na2SO3 、硫酸两个角度去考虑。
(1)了解化学实验常用仪器的主要用途和使用方法。 (2)掌握化学实验的基本操作。 (3)掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。 (4)综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别。 (5)掌握化学实验的记录方法和运用化学知识设计一些基本实验:①根据实验现象,观察、记录、分析或处理数据,得出正确结论。②根据实验试题要求,设计基本实验方案。③能绘制和识别典型的实验仪器装置图。 (6)以上各部分知识与技能的综合应用。
2.考察角度
(1)用正确的化学实验基本操作,完成规定的“学生实验”的能力。 (2)观察记录实验现象,分析实验结果和处理实验数据,得出正确结论的能力。 (3)初步处理实验过程中的有关安全问题的能力。 (4)能识别和绘制典型的实验仪器装置图的能力。 (5)根据实验试题的要求,设计简单实验方案的能力
光阴里那些手绘的花朵
安宁
(1)那时我已经开始爱美,会在肥大校服的里面穿碎花的衬衫,天热的时候,将校服的拉链尽可能低地拉下去,露出那一蓬一蓬散漫开着的花。
(2)那时的我们真是单纯任性,十五六岁吧,总抓住一切可以不穿校服的机会,放任自己妖饶地绽放。老师站在讲台上,看见谁故意将校服穿得凌乱不堪,就会板起面孔说教一通。而我们,则会在课下凑在一起,七嘴八舌地讲这个老师的“坏话”,一直讲到心满意足,才又回复到嬉笑打闹、爱臭美的一群。
(3)有一次上美术课,老师将一盆茉莉花摆在桌子上让我们描摹。邻桌叫茉的女孩,却偷偷地在自己校服的内侧画上了一朵花瓣柔软芬芳的茉莉。画完了,她转过头来,欣喜地要我与她分享。我刚刚瞥了一眼那朵呼之欲出的茉莉,还没来得及惊讶于茉的大胆笔法,老师便一脸威严地走了过来,然后不容分说地让我和茉站到讲台上去。
(4)惊恐中,我与茉肩并肩地站着。老师让茉给大家“展示”一下她的艺术作品。明知道这是故意的嘲弄,但茉却骄傲地朝老师微微一笑,而后打开校服的一侧,又像鸟儿打开翅膀一样,铺展开另一侧。我小心地顺着老师恼怒的视线朝茉看去,这才吃惊地发现,她校服内侧的右边竟然开满了大朵大朵绚烂的山茶花。当她背过身去,将衣领内侧也翻开来,竟又是一条长长的青藤!
(5)我依然清晰地记得,这场由茉引起的手绘风潮,在我们的校园犹如一道雨后的彩虹,张扬炫目地挂在天边,让每一个人都渴望走近它,采摘一片,放入背后的行囊。
(6)从那时起,我们手绘自己喜欢的花草、飞鸟、童话、歌曲、明星、格言;我们还自创抽象唯美又神秘莫测的图案,而其中蕴含的爱恨,除了校服的主人,无人能解… … 这股手绘的潮流,缤纷了原本单调的校服。
(7)昔日总强迫我们穿校服的体育老师喜上眉梢,因为我们终于不用他耳提面命才勉强穿着校服绕操场跑步了。我们满怀激情地在青春的岁月里迎风奔跑,那些绘满青春符号的校服,像是猎猎彩旗,张扬地舞动,鲜亮的青春符号在阳光下熠熠闪光。
(选自(《读者》原创版2008 年合订本,有改动)
9.根据文意,你认为文题中“手绘的花朵”包括哪些含义?(4分)
答:
10.本文第(4)段末尾省略了“茉”展示手绘作品后班级同学的反应,请展开合理想象,补上这段描写性文字(60字以内)。(4分)
答:
11.本文生动地刻画了“茉”这一人物形象,请结合具体语句,谈谈“茉”给你留下的最深的印象。(4分)
答:
12.对于在校服上手绘图案这种现象,有人赞成,有人反对,请简要谈谈你的看法。(5分)
答:
21.缸的妻为什么哭了?请结合全文作简要分析。(4分)
答:
20.第(8)(9)自然段的细节描写有何好处?(3分)
答:
19.挨打总是痛苦的,作者在第(2)自然段中却说是“应该的”,你如何理解?(3分)
答:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com