
2.答案:B
解析:加热、发生原电池反应、增大固体反应物的表面积,都能加快反应速率;浓硫酸能使铁发生钝化,阻止了进一步的反应。
1.答案:C
解析:根据化学反应中速率比等于各物质的化学计量数之比,vA∶vB=1∶2,而vA=1 mol·
L-1·min-1,则vC=2 mol·L-1·min-1。
12.(1998年上海,26)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
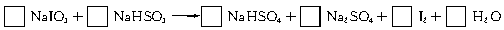
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO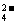 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:
。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:
。
●答案解析
11.(2001年上海,24)某化学反应2A===B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
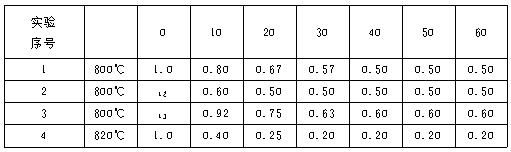
(1)在实验1,反应在10至20分钟时间内平均速率为 mol·(L·min)-1。
(2)在实验2,A的初始浓度c2=__________mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”“=”或“<”=,且c3__________1.0 mol·L-1(填“<”“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。理由是 。
10.(2001年全国,21)在120℃时分别进行如下四个反应:
A.2H2S+O2===2H2O+2S B.2H2S+SO2===2H2O+2SO2
C.C2H4+SO2===2H2O+2CO2 D.C4H8+6O2===4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是__________;符合关系式d前=d后和p前=p后的是__________;(请填写反应的代号)
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是__________,符合d前>d后和V前>V后的是__________。(请填写反应的代号)?
9.(1995年全国,19)反应4NH3+5O2 4NO+6H2O在5 L 密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L 密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率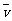 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为
A.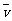 (O2)=0.01
mol·L-1·s-1
(O2)=0.01
mol·L-1·s-1
B.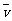 (NO)=0.008 mol·L-1·s-1
(NO)=0.008 mol·L-1·s-1
C.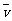 (H2O)=0.003
mol·L-1·s-1
(H2O)=0.003
mol·L-1·s-1
D.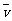 (NH3)=0.002
mol·L-1·s-1
(NH3)=0.002
mol·L-1·s-1
8.(1995年全国,13)在下列四种溶液中,加入少量固体二氧化锰,能生成气体的是
A.3%H2O2溶液 B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 KClO3溶液 D.1 mol·L-1盐酸
7.(1996年上海,9)对某一可逆反应来说,使用催化剂的作用是
A.提高反应物的平衡转化率
B.以同样程度改变正逆反应的速率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
6.(1997年上海,8)设C+CO2 2CO-Q1,反应速率为v1;N2+3H2
2CO-Q1,反应速率为v1;N2+3H2 2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
5.(1998年上海,15)反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
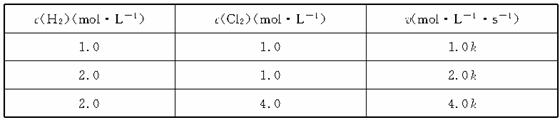
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=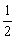 ,n=
,n=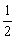
C.m=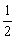 ,n=1? D.m=1,n=
,n=1? D.m=1,n=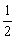
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com