
23.(14分)
I.某同学欲测定硫酸铜晶体中结晶水的含量。他列出的实验用品为:硫酸铜晶体试样、研钵、坩埚、坩埚钳、酒精灯、三脚架、玻璃棒、药匙、托盘天平。 回答下面问题:
(1)完成本实验还需要的实验用品有 。
(2)下面的情况有可能造成测定结果偏低的是 (填序号)。
A.试样中含有易挥发的杂质 B.加热时有晶体溅出 ’
C.晶体加热脱水不完全 D.实验前坩埚未完全干燥 E.硫酸铜受热分解
Ⅱ.该同学发现硫酸铜晶体加热后变黑,查阅资料得知:硫酸铜在加热条件下生成CuO、SO2、O2、SO3。现用下图所示的装置验证硫酸铜在加热分解时有SO2产生,并测量产生的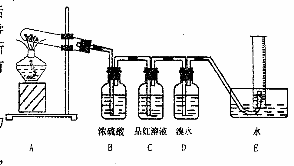 O2的体积。
O2的体积。
试填写下列空白:
(1)硫酸铜受热分解的化学方程式 为 。
(2)装置B的作用是 ,
(3)停止加热时,测量收集到的气体体积必须包括以下几步:
① ; ②调整量筒内外液面高度使之相同;
③读取量筒内气体的体积。
(4)Y为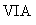 族元素构成的气态单质,将Y和SO2分别通人品红溶液,都能使品红溶液褪色。则Y的化学式为
;简述区别二者的实验方法
。
族元素构成的气态单质,将Y和SO2分别通人品红溶液,都能使品红溶液褪色。则Y的化学式为
;简述区别二者的实验方法
。
22、(12分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的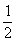 ,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
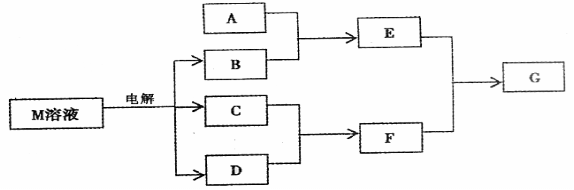 (1)若A是与X、Y同周期的一种常见金属单质,则A与B溶液反应的化学方程式是: ;
(1)若A是与X、Y同周期的一种常见金属单质,则A与B溶液反应的化学方程式是: ;
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则E与F反应的离子方程式是: ;
(3)若A是一种常见的化肥,式量为79,且E和F生成G时有白烟生成,则A和足量B反应的离子方程式___________________________,G的电子式_______
21.(14分)元素周期表揭示了许多元素的相似性和递变规律。同一周期构成的某些微粒往往具有相同的电子数,如周期表中主族元素可以构成许多电子数为10或18的微粒。下列周期表中列出一些均与对应元素有关的18电子微粒。
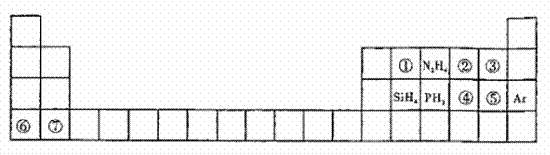
(1)①为8核微粒,其名称为_________;②的电子式____________,PH3的空间构型为______
(2)④⑤⑥⑦对应元素形成的简单离子半径从小到大的顺序为__________________(用离子符号表示)。
(3)写出③参加的置换反应的化学方程式___________________。
(4)④对应的某种18电子的离子与 和
和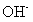 均可发生反应,写出其与OH-反应的离子方程式:_____________________________
均可发生反应,写出其与OH-反应的离子方程式:_____________________________
(5)在火箭推进器中装有液态N2H4和液态②,已知0.4mol液态N2H4和足量液态②反应,生成一种气态单质和气态氢化物,放出256.6kJ的热量,则该反应的热化学方程式为________________________________________。
20.硝酸与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH4+中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质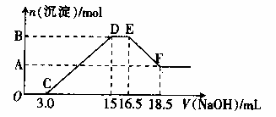 的量的关系如下图,则下列说法中不正确的是( )
的量的关系如下图,则下列说法中不正确的是( )
A.与HNO3反应后,Fe元素的化合价为+3
B.D→E段反应的离子方程式为
NH4++OH-=NH3·H2O
C.纵坐标A点数值为0.008
D.纵坐标B点数值为0.012
第Ⅱ卷
19.X、Y、Z、W四种主族元素均在短周期,且原子序数依次增大。已知X、Z两元素原子的最外层电子数均为其电子层数的2倍;Y、W的最外层电子数相同。下列说法中正确的是( )A.X、Z两元素的氢化物分子中均含4对共用电子对
B.Y、Z、W均可分别与X形成非极性分子
C.Y的氢化物沸点比W的氢化物沸点低
D.Y的单质可与冷水反应并置换出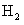
18.下列实验操作中,正确的是
①准确称取4.0g的NaOH固体溶于1L水配成浓度为1.0 mol·L-1的溶液
②用10 mL 量筒量取5.2mL盐酸
③用蒸发皿加热NaCl溶液可以得到NaCl晶体
④用100 mL容量瓶稀释18mol•L-1浓 H2SO4溶液
⑤用带玻璃塞的棕色试剂瓶存放浓HNO3
⑥中和热测定的实验中使用的玻璃仪器只有2种
⑦将一小块pH试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸
上,再与标准比色卡对照
A.②④⑦ B.②⑤⑥
C.②③⑤ D.①②③
17..Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O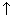 。下列说法正确的是
。下列说法正确的是
A .石墨电极发生氧化反应
B. 石墨电极上产生氢气
C. 铜电极发生还原反应
D.当有0.1mol电子转移时,有0.1molCu2O生成。
16.
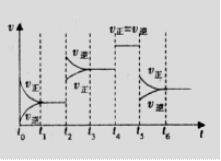 某密闭容器中发生如下反应: A(g)+B(g) 2C(g);△H<0,反应速 率(
某密闭容器中发生如下反应: A(g)+B(g) 2C(g);△H<0,反应速 率(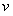 )随时间(
)随时间(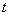 )变化的关系如图,
)变化的关系如图,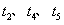 时刻外界条件改 变,但都没有改变各物质加入量。下列说法正确的是 A.
时刻外界条件改 变,但都没有改变各物质加入量。下列说法正确的是 A.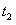 时增大了压强
时增大了压强
B.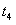 时一定使用了催化剂
时一定使用了催化剂
C.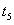 时降低了温度
时降低了温度
D. 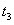 -
-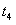 时间内A的百分含量比
时间内A的百分含量比 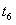 后低
后低
15.为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。发生的化学反应为:
4CuI+Hg = Cu2HgI4+2Cu 。下列说法不正确的是
A.上述反应属于置换反应 B.该反应中的氧化剂为CuI
C.Cu2HgI4既是氧化产物又是还原产物
D.当有1 mol CuI参与反应时,转移电子的物质的量为0.5 mol
14..现有浓度均为0.1 mol/L ① 醋酸溶液 ② 氯化铵溶液 ③ 硫酸溶液各25 mL 。下列说法正确的是
A.3种溶液pH 大小的顺序为①﹥②﹥③
B.3种溶液中由水电离产生的氢离子浓度大到小顺序是②﹥①﹥③
C.若将3种溶液稀释相同倍数,pH 变化最大的是①
D.若分别加入25mL 0.1mol/L的氢氧化钠溶液后,pH 最大的是①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com