
6.化简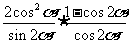 的结果为
的结果为
A.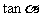 B.
B.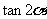 C.
C.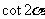 D.1
D.1
5.若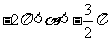 ,则
,则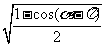 的值等于
的值等于
A.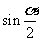 B.
B.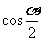 C.
C. D.
D.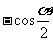
4. 设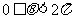 ,如果
,如果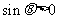 且
且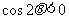 ,那么
,那么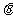 的取值范围是
的取值范围是
A.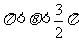 B.
B. C.
C.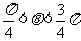 D.
D.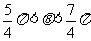
3.下列与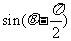 的值相等的式子为
的值相等的式子为
A.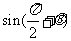 B.
B.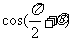 C.
C.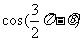 D.
D.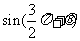
2.已知点P (sin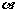 – cos
– cos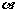 ,tan
,tan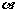 )在第一象限,则在[0,2
)在第一象限,则在[0,2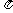 ]内
]内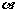 的取值范围是
的取值范围是
A.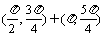 B.
B.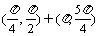 C.
C.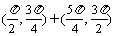 D.
D.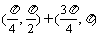
1.若f(sinx)=3-cos2x,则f(cosx)=
A 3-cos2x B 3-sin2x C 3+cos2x D 3+sin2x
1.强酸(HClO4、HI、HBr、HCl、H2SO4、HNO3、H+)可以和强酸的酸根离子共存;但不能与弱酸根离子共存(F-、CO32-、ClO-、S2-、SiO32-等) 2.强碱(KOH、NaOH、Ba(OH)2等)OH-与弱碱的阳离子(如Cu2+、NH4+、Al3+等)不能共存。 3.弱酸的酸式根离子与H+、OH-都不能共存,如HCO3-、HS-、HSO3-、HPO42-等。但强酸的酸式根离子只与碱不能共存,如HSO4-。 4.相关离子的颜色:MnO4-为紫色;Fe3+为棕黄色;Fe2+为浅绿色;Cu2+为蓝色。 5.电解质溶液中至少有一种阳离子和一种阴离子。
复分解反应是有难溶物(微溶物)生成、难电离物质生成、易挥发物质生成。由于难溶物、难电离物微粒之间有比较强的相互作用,分子难以电离成离子;挥发性物质生成并从溶液中分离,都导致溶液中离子浓度降低,使离子不能大量共存。如Cl-与Ag+;Ba2+与SO42-;CO32-、H+;H+、OH-;OH-与NH4+;H+、CH3COO-等。 2.强氧化剂和强还原剂不能共存(但Fe3+、Fe2+因没有中间价态可以共存) 常见强氧化剂:硝酸;浓硫酸;MnO4-(H+)溶液;高铁离子(Fe3+);NO3-(H+)溶液;含有ClO-在酸、碱性的溶液中都有强氧化性。 常见强还原剂:I-;Fe2+;+2价硫(如S2-、HS-、H2S);+4价硫(SO2、SO32-、HSO3-)等。 3.发生双水解反应使离子浓度降低。 盐溶液中,弱酸的阴离子和弱碱的阳离子容易发生水解,某些离子相遇形成弱酸弱碱盐时,阴阳离子相互促进水解,使平衡向水解方向移动而水解完全,使溶液中的离子浓度迅速降低。常见易发生双水解的阳离子有(Fe3+或Al3+)与(CO32-、HCO3-、AlO2-)的组合。 Al3++3HCO3-=Al(OH)3↓+3CO2↑ 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ Al3++3 AlO2-+6H2O=4Al(OH)3↓ 4.发生络合反应使离子浓度降低。 如Fe3+与SCN-等。 三、离子共存问题常见的典型问题 1. Al(OH)3有酸式电离和碱式电离:,增加或OH-、Al3+浓度;或者增加H+、AlO2-离子浓度,都可以使平衡朝生成沉淀的方向移动。因此OH-、Al3+;H+、AlO2-不能共存,但OH-、AlO2-;Al3+、H+可以共存。 2.Fe2+、NO3-可以共存,但有H+时不能共存,因为HNO3具有强氧化性。 3.某溶液与铝反应可以生成氢气,在该溶液中不一定存在与H+或者OH-可以共存的离子。 4.常温下,某溶液中由水电离出的H+为0.01mol/L,则该溶液可能是pH=2或者pH=12的溶液。该溶液为酸性或碱性,有H+或者OH-。 5.某种溶液中有多种阳离子,则阴离子一般有NO3-;某种溶液中有多种阴离子,一般阳离子有K+、Na+、NH4+中的一种或几种。 6.酸性条件下 ClO-与Cl-不共存
离子共存问题(高考热点) ⒈离子在溶液中能否大量共存首先应看其能否发生以下反应: ⑴能发生复分解反应,即能够形成沉淀、易挥发性物质(气体)、弱电解质(如水、弱酸、弱碱等)的离子不能大量共存。其中,微溶物如CaSO4等少量可以共存,大量不能共存。 例1、下列各组离子在水溶液中能大量共存的是( A ) (A)Na+、Ba2+、OH-、AlO2-
(B)H+、Na+、Cl-、SO32-
(C)H+、Na+、HPO42-、NO3-
(D)K+、Ca2+、ClO-、SO42- ⑵能发生完全双水解的阴阳离子在水溶液中不能大量共存。 例2、下列各组离子在水溶液中能够大量共存的是( C ) (A)Al3+、SO42-、HCO3-、NO3-
(B)NH4+、Cl-、SiO32-、SO42-
(C)NH4+、NO3-、CH3COO-、HCO3-
(D)Fe3+、Cl-、HCO3-、NO3- [总结]一般地,生成物中有沉淀或气体产生的双水解反应可以完全进行。 ⑶能发生氧化还原反应的离子不能大量共存。 例3、下列各组离子在水溶液中不能大量共存的是( BC ) (A)Na+、Mg2+、NO3-、I- (B)H+、Fe2+、NO3-、Cl- (C)Na+、K+、ClO-、S2- (D)H+、Fe2+、SO42-、I- ⑷能形成络合物的离子不能大量共存,如 Fe3+ 和SCN- 。 ⒉注意题干的附加条件。如“无色溶液”中不应含MnO4-、Fe2+、Fe3+、Cu2+等有色离子;又如“pH=1的溶液”中有大量H+,再如“加入金属铝有H2放出的溶液”或“由水电离出的H+的浓度为10-13mol•L-1的溶液”可能有大量H+或OH-。 例4、下列各组离子中,在[H+]=10-13mol•L-1的溶液中能大量共存,且加入NaHSO4溶液过程中会产生气体和沉淀的是( C ) (A)Na+、NO3-、AlO2-、Cl- (B)Na+、K+、NO3-、SiO32- (C)K+、Cl-、AlO2-、CO32- (D)Na+、Mg2+、HCO3-、Cl- [练习]⒈下列各组离子在水溶液中不能大量共存的是( AC ) (A)H+、Na+、CH3COO-、Cl- (B)Na+、[Ag (NH3)2]+、OH-、NO3- (C)H+、K+、MnO4-、Cl- (D)Na+、K+、AlO2-、NO3- ⒉某溶液中加入金属铝有H2放出,则下列各组离子在该溶液中一定能大量共存的是( 1 2 ) ;一定不能大量共存的是(4567 ) ;可能大量共存的是( 389 ) ⑴Na+、K+、Cl-、SO42- ⑵Na+、K+、Ba2+、Cl- ⑶Na+、Mg2+、Cl-、SO42- ⑷K+、Ba2+、Cl-、SO42- ⑸K+、Mg2+、NO3-、SO42- ⑹K+、NH4+、Cl-、CO32- ⑺K+、Na+、Cl-、HCO3- ⑻K+、Ca2+、Br-、Cl- ⑼K+、Na+ 、AlO2-、SO42- ⒊某无色透明的溶液跟金属铝反应时放出H2,试判断下列离子Mg2+、Cu2+、H+、Ba2+ 、Ag+、SO42-、SO32-、HCO3-、OH-、NO3-何者能大量在此溶液中共存。 ⑴当生成Al3+时可存在 H+、Mg2+ SO42-;⑵当生成AlO2-时可存在 OH-、 Ba2+、 NO3-
窗体底端
2.加入铝粉有氢气产生 3.HCO3-离子不能稳定存在的溶液
离子共存之三 在溶液中离子共存问题的实质是哪些离子之间不能发生反应。能够发生反应的离子就不能共存,不能够发生反应的离子才可以共存。 (1)离子间能直接结合生成难溶性物质时,则这些离子不能大量共存。如SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、Br-、I-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与CO32-、SO32-、PO43-;S2-与Cu2+、Pb2+等不能大量共存。 (2)离子间能结合生成难电离物质时,则这些离子不能大量共存。 如OH-、ClO-、CH3COO-、HPO42-、H2PO4-与H+;HCO3-、HS-、HSO3-、H2PO4-、HPO42-、H+与OH-等不能大量共存。 (3)离子间能结合生成挥发性物质时,则这些离子不能大量共存。 如CO32-、SO32-、HCO3-、HSO3-、S2-、HS-与H+;NH4+与OH-等不能大量共存。 (4)离子之间能发生氧化还原反应时,则这些离子不能大量共存。 一般说来,有氧化性的离子(如MnNO4-、ClO-、Fe3+、NO3-等)与有还原性的离子(如S2-、Br-、I-、SO32-、Fe2+等)不能大量共存。
注意以下几种情况: ①在有H+存在时,MnO4-、ClO-、NO3-的氧化性会增强。 ②Fe3+与Fe2+可以共存,因为它们之间不存在中间价态。 Fe3+不能氧化Cl-。 ③NO3-(有H+时)不能氧化Cl-。 ④还应注意题目是否给出溶液的酸碱性,是否给定是在无色溶液中。在酸性溶液中除题给离子外,还应有大量H+;在碱性溶液中除题给离子外,还应有大量OH-。若给定溶液为无色时,则应排除Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-(紫色)。
2.使pH变蓝 3.使红色石蕊变蓝 4.酚酞呈红色 5.甲基橙呈黄色 6.c(H+)为十的负十四次方
可酸可碱的条件 1.水电离c(OH-)或者c(H+)浓度为十的负N次方摩尔每升
1. PH=1的溶液 2.使紫色石蕊溶液呈红色 3.使甲基橙呈红色 4.加镁粉放氢气 5.c(oH-)为十的负十四次方 隐含有H-
限制碱性的条件 1.PH=14的溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com