
6.等效替代法
5. 整体法和隔离法 、
4. 微元法
3. 构建模型法
3. 图象法
2.
1. 合成分解法
45.(09年山东理综·30)(16分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、S1的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
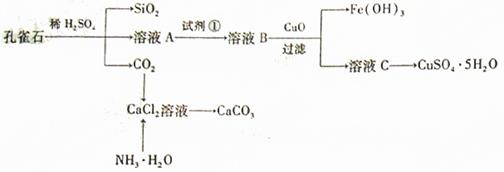
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发, 。过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
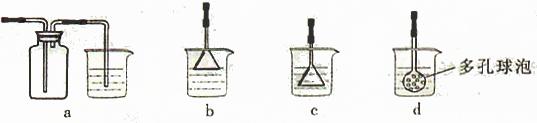
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
答案:(1)c d
(2)冷却结晶 引流
(3)NH3·H2O b
(4)注视凹页面的最低处与刻度线 凹页面的最低处与刻度线相平 酸式
 解析:(1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+ 选择SCN- (2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
解析:(1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+ 选择SCN- (2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
 [考点分析]考查化学实验的基本操作、物质的提纯与鉴别、实验室安全等
[考点分析]考查化学实验的基本操作、物质的提纯与鉴别、实验室安全等
44.(09年山东理综·28)(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-
 H1=1175.7
kJ·mol-1
H1=1175.7
kJ·mol-1
PtF6(g)+e-=PtF6-(g)
 H2=-771.1
kJ·mol-1
H2=-771.1
kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
 H3=482.2
kJ·mol-1
H3=482.2
kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4*)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
答案:(1)向左 不改变
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O = Cu(OH)2↓ +2NH4+
(4)中  mol·L-1
mol·L-1
解析:(1)恒温、恒压条件下向平恒体系中通入氩气,则反应体系体积增大,平衡左移;使用催化剂只是改变了反应的途径,没有改变反应物与生成物的状态,△H不变;(2)利用盖斯定律,△H1+△H2+(-△H3)= -77.6 kJ·mol-1;(3)由于,KsP [Cu(OH)2]=2.2×10-20<Ksp[Mg(OH)2]=1.8×10-11,所以先生成沉淀;2NH3·H2O+Cu2+=Cu(OH)2↓+2 NH4*;根据溶液的电中性原则,c(NH4*)=c(Cl-),则[H+]=[OH-];溶液显中性;Kb= ,c(NH4*)=c(Cl-)=0.005 mol·L-1;[H+]=[OH-]=1×10-7 mol·L-1(因为是25℃下且为中性);[NH3·H2O]=mol·L-1-0.005 mol·L-1,则:Kb=mol·L-1。
43.
 (09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

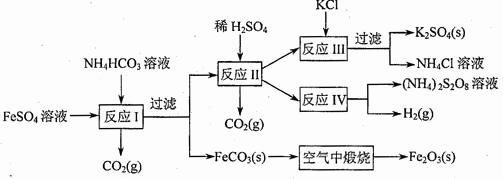
 (1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
 A.锌粉 B.铁屑 C.KI溶液 D.H2
A.锌粉 B.铁屑 C.KI溶液 D.H2
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
 答案:(1)B
答案:(1)B
 (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4
的溶解度,有利于K2SO4 析出。
(3)降低K2SO4
的溶解度,有利于K2SO4 析出。
 (4)2SO42-
-2e-
(4)2SO42-
-2e- 2S2O82-
2S2O82-
 解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好选用铁屑或铁粉,比较简单。(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。(3)由题目看出在III反应中生成的K2SO4
为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好选用铁屑或铁粉,比较简单。(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。(3)由题目看出在III反应中生成的K2SO4
为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
 (4)根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
(4)根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
 [考点分析]此题为化工生产题型,主要考察了化合物性质,电极方程式书写。做此类题要分析清楚每一个环节目的和结果是什么。这样才能判断各反应后的产物分别是什么。
[考点分析]此题为化工生产题型,主要考察了化合物性质,电极方程式书写。做此类题要分析清楚每一个环节目的和结果是什么。这样才能判断各反应后的产物分别是什么。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com