
32.(14分)(08年宁夏理综·26)
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
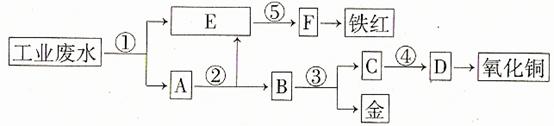
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
答案:(14分)
(1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
解析:首先用过量铁屑将H+、Fe3+、Cu2+、Au3+等离子还原成H2、Fe2+、Cu、Au,发生4个反应,E中应为Fe2+,因为后面生成铁红,故⑤为碱液氢氧化钠,试剂②是将过量铁屑溶解,试剂③是将Cu、Au分离应为稀硝酸,从C中的Cu2+到氧化铜,也应为碱液氢氧化钠。
31.(07年广东化学·21)(10分)
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
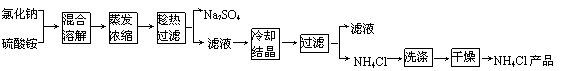

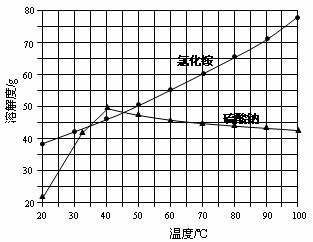
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
答案:(10分)
(1)11.7
(2)蒸发皿
(3)35℃(33~40℃均可得分)
(4)加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净。
(5)重结晶
解析:难度,中,本题考查学生对质量守恒定律的理解以及对化学实验室常用的仪器主要用途的了解,考查学生应用基础知识解决简单化学问题的能力以及学生对图表的观察、分析能力。根据氯守恒可列关系求m(NaCl)= 10.7g·58.5g /mol ¸53.5g/mol=11.7g,氯化铵的溶解度随温度变化较大,而硫酸钠在30~100℃变化不大,故可有冷却结晶法以。但温度不能太低以防硫酸钠析出。所以应大约在33~40℃。
30.(07年广东化学·26)(12分)
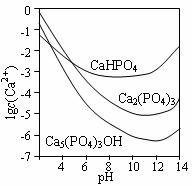
羟基磷灰石[Ca3(PO4)3OH]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+ +
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是 。
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。
答案:(12分)
(1)①10NH4NO3 3H2O ②Ca5(PO4)3OH↓+9H2O
(2)唯一副产物为水,工艺简单
(3)反应液局部酸性过大,会有CaHPO4产生
(4)Ca5(PO4)3OH
(5)酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
解析:难度,中等,本题考查学生对难溶电解质的溶解平衡和酸碱反应的了解,考查学生书写化学反应方程形式的能力、读图解析和方案评价能力,以及化学平衡知识的综合应用能力。根据原子守恒可以配平反应方程式,方法A与方法B对比,主要是A产物有副产物NH4NO3,原子利用率不高。本题后二问要利用平衡思想解决,人体pH基本上在7.39~7.41,所以钙主要存在形式为Ca5(PO4)3OH,结合其电离平衡可以分析酸会促进其电离而溶解,造成龋齿。
29.(07年广东化学·24)(10分)
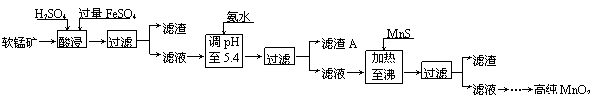 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写出两种)。
答案:(10分)
(1)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3 Al(OH)3
(3)Cu2+ Zn2+
(4)MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-)
(5)锌、二氧化锰
解析:考查学生对元素化合物的主要性质的掌握、书写电极反应方程形式的能力以及学生能够从试题提供的新信息中,准确地提取实质内容,并与已有知识模块整合,重组为新知识模块的能力。由反应流程可知:在酸性条件下二氧化锰将Fe2+氧化为Fe3+,将Cu氧化成Cu2+,此外溶液中的还有Zn2+和Al3+,当调pH至5.4时,只有Al(OH)3 和Fe(OH)3会完全沉淀,故滤渣A的主要成分是Fe(OH)3和Al(OH)3。加入MnS后因为酸性条件下CuS 、ZnS更难溶所以会转化为CuS 、ZnS沉淀而除去Cu2+ Zn2+。
24.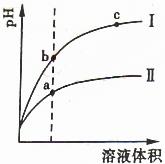 (09年山东理综·15)某温度下,相同pH值的盐酸和酸溶液分别是稀、平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是
(09年山东理综·15)某温度下,相同pH值的盐酸和酸溶液分别是稀、平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是 学科
学科
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Ka的数值比c点Ku的数值大
D.b点酸的总浓度大于a点酸的总浓度
答案:B
解析:本题以醋酸为例考查了弱电解质的电离平衡,II应为醋酸稀释时的pH值变化曲线;溶液导电性取决于离子浓度,b点的H+浓度大,导电性强;KW的大小只取决于温度;相同pH值的盐酸和醋酸,醋酸浓度远大于盐酸的浓度,稀释到相同体积时,醋酸(II)浓度大于盐酸(I)浓度。
25 .(09年天津理综·2)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
.(09年天津理综·2)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
 A.均存在电离平衡和水解平衡
A.均存在电离平衡和水解平衡
 B.存在的粒子种类相同
B.存在的粒子种类相同
 C.c(OH-)前者大于后者
C.c(OH-)前者大于后者
 D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
答案:C
解析:相同浓度时,Na2CO3的碱性强于NaHCO3,C项错。
26 .(09年天津理综·4)下列叙述正确的是
.(09年天津理综·4)下列叙述正确的是
 A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
 B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
 D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
答案:D
解析:A项,苯酚钠为碱性溶液,故错;B项,温度不变,则Kw是不变的,错;C项,pH=5即代表溶液中c(H+)均为10-5mol/L,错。D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确。
27 .(09年海南化学·6)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
.(09年海南化学·6)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
 A.该溶液的pH=4
A.该溶液的pH=4
 B.升高温度,溶液的pH增大
B.升高温度,溶液的pH增大
 C.此酸的电离平衡常数约为1×10-7
C.此酸的电离平衡常数约为1×10-7
 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
答案:B
解析:根据HA在水中的电离度可算出c(H+)=0.1×
0.1%mol·L-1=10-4 mol·L-1,所以pH=4;因HA在水中有电离平衡,升高温度促进平衡向电离的方向移动,所以c(H+)将增大,pH值会减小;C选项可由平衡常数表达式算出K= =1×10-7 ,所以C无错误。c(H+)=10-4
mol·L-1 ,所以c(H+,水电离)= 10-10
mol·L-1,前者是后才的106倍。
=1×10-7 ,所以C无错误。c(H+)=10-4
mol·L-1 ,所以c(H+,水电离)= 10-10
mol·L-1,前者是后才的106倍。
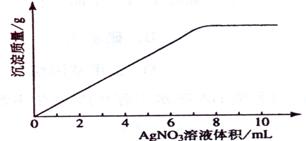
28 .(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:
.(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:

 A.+1 B.+2 C.+3 D.+4
A.+1 B.+2 C.+3 D.+4
答案:C
解析:设氯化物化学式为MClx
MClx -- x AgNO3
1 x
5mL×0.05 mol·L-1 0.1 mol·L-1×7.5mL
x = 3
23.(09年山东理综·13)下列推断合理的是
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色
答案:A
解析:明矾[KAl(SO4)2·12H2O]溶于水,电离产生的Al3+在中水解生成能吸附水中悬浮杂质的Al(OH)3胶体,故可用作净水剂;金刚石、石墨均可以燃烧生成二氧化碳;浓H2SO4虽然有强氧化性,只有加热才能与Cu发生反应;SO2通入溴水后发生氧化还原反应,SO2 +Br2 + 2H2O= H2SO4+2HBr,加热不可能生成Br2.
22.(09年宁夏理综·11)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
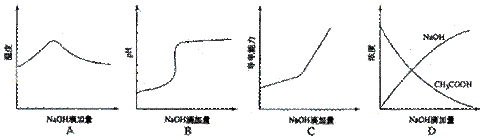
答案:D
解析:A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低。B选项醋酸中滴加氢氧化钠酸性减弱pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,因此氢氧化钠开始时为0.
[点评]本题考查水溶液中的离子反应的相关知识,题目容量大,对考生的能力要求很高。
18.(09年广东理基·33)下列说法正确的是
A.向0.1mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3-、Cl-、CO32-、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D. 分别于等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同
答案:A
解析:Na2CO3溶液中存在CO32-的水解CO32-+H2O HCO3-+OH-,使溶液显碱性,因此加入酚酞后溶液变为红色,故A选项正确。B选项中pH=2的溶液显酸性,弱酸跟阴离子CO32-不能存在;C选项中的乙醇不是电解质,只有乙酸是电解质;HCl是一元酸而H2SO4是二元酸,因此等物质的量的HCl和H2SO4消耗的NaOH的物质的量之比为1︰2。
HCO3-+OH-,使溶液显碱性,因此加入酚酞后溶液变为红色,故A选项正确。B选项中pH=2的溶液显酸性,弱酸跟阴离子CO32-不能存在;C选项中的乙醇不是电解质,只有乙酸是电解质;HCl是一元酸而H2SO4是二元酸,因此等物质的量的HCl和H2SO4消耗的NaOH的物质的量之比为1︰2。
19 .(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
.(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
 A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
 B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.MgO的熔点很高,可用于制作耐高温材料
C.MgO的熔点很高,可用于制作耐高温材料
 D.电解MgCl2饱和溶液,可制得金属镁
D.电解MgCl2饱和溶液,可制得金属镁
 答案:D
答案:D
 解析:A项,明矾净水的原理是Al3++3H2O
解析:A项,明矾净水的原理是Al3++3H2O Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O
Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融)
Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
 [考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
[考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
 20
20 .(09年江苏化学·9)下列化学实验事实及其解释都正确的是
.(09年江苏化学·9)下列化学实验事实及其解释都正确的是
 A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
 B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
 C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
 D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1
AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp
D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1
AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp
 答案:AD
答案:AD
 解析:A项,是高中化学必修1一个很重要的实验---萃取实验;B项的叙述是错误的,在该实验中根本得不到白色沉淀,因为亚硫酸不可能制取盐酸;C项只能说明Fe2+具有还原性,因为KMnO4具有强氧化性,常做氧化剂。D项,沉淀呈黄色,说明沉淀是AgI,也就意味着AgCl的Ksp比AgI的大。
解析:A项,是高中化学必修1一个很重要的实验---萃取实验;B项的叙述是错误的,在该实验中根本得不到白色沉淀,因为亚硫酸不可能制取盐酸;C项只能说明Fe2+具有还原性,因为KMnO4具有强氧化性,常做氧化剂。D项,沉淀呈黄色,说明沉淀是AgI,也就意味着AgCl的Ksp比AgI的大。
 [考点分析]
[考点分析]
 ①重要试验的操作过程、实验现象、结论和解释应牢记;
①重要试验的操作过程、实验现象、结论和解释应牢记;
 ②Ksp的运用。
②Ksp的运用。
 21
21 .(09年江苏化学·13)下列溶液中微粒的物质的量浓度关系正确的是
.(09年江苏化学·13)下列溶液中微粒的物质的量浓度关系正确的是
 A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
 B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
 C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
 D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
 答案:AC
答案:AC
 解析:B项,NaHCO3溶液中,OH-是由HCO3- 水解和水的电离所出成的,但是这些都是微弱的。HCO3- 的浓度永大于OH-浓度,故错;D项,由电荷守恒有:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ,由物料守恒可得:2c(Na+)= c(CH3COO-)+ c(CH3COOH),将两式中的c(Na+) 消去,可得c(CH3COO-)+2c(OH-)=2c(H+)+ c(CH3COOH)。所以c(CH3COO-)+c(OH-)-c(H+)-c(CH3COOH)= c(H+)-c(OH-),因为pH=4.75,故c(H+)-c(OH-)>0,所以D项不等式应为”>”
,故错。
解析:B项,NaHCO3溶液中,OH-是由HCO3- 水解和水的电离所出成的,但是这些都是微弱的。HCO3- 的浓度永大于OH-浓度,故错;D项,由电荷守恒有:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ,由物料守恒可得:2c(Na+)= c(CH3COO-)+ c(CH3COOH),将两式中的c(Na+) 消去,可得c(CH3COO-)+2c(OH-)=2c(H+)+ c(CH3COOH)。所以c(CH3COO-)+c(OH-)-c(H+)-c(CH3COOH)= c(H+)-c(OH-),因为pH=4.75,故c(H+)-c(OH-)>0,所以D项不等式应为”>”
,故错。
 [考点分析]
[考点分析]
 ①混合溶液中离子浓度的关系,电荷守恒。
①混合溶液中离子浓度的关系,电荷守恒。
 ②等pH的溶液中物质的量浓度的大小关系
②等pH的溶液中物质的量浓度的大小关系
 ③电离和水解的相互关系
③电离和水解的相互关系
 ④酸式盐溶液中离子的浓度大小关系
④酸式盐溶液中离子的浓度大小关系
17.(09年广东理基·27)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法
|
选项 |
污染物 |
处理措施 |
方法类别 |
|
A |
废酸 |
加生石灰中和 |
物理法 |
|
B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
|
C |
含苯废水 |
用活性炭吸附 |
物理法 |
|
D |
含纯碱的废水 |
加石灰水反应 |
化学法 |
答案:D
解析:A选项废酸中加生石灰中和是化学处理法,错误。B选项中加硫酸盐不能使Cu2+形成沉淀,错误。C选项中用活性炭不能吸附苯,错误。D选项中加石灰水后纯碱会形成CaCO3沉淀而除去,属于化学处理法,正确。
16.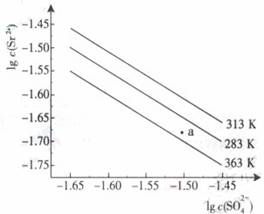 (09年广东化学·18)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
(09年广东化学·18)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到263K后变为不饱和溶液
答案:BC
解析:平衡常数只与温度有关,与物质的浓度无关,A错误;温度一定时Ksp=[Sr2+][SO42-],由图可知,313K时,相同SO42-浓度下,Sr2+的浓度最大,所以平衡常数最大,B正确;283K时,Sr2+的浓度比平衡时要小,Qc小于Ksp(283K),对应为不饱和溶液,C正确;283K下的饱和溶液,突然升温至363K,Ksp减少,析出沉淀,仍然为饱和溶液,D错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com