
10.已知0.02 mol·L-1CH3COOH溶液和0.01 mol·L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的
A.c (CH3COO-)>c (Na+)
B.c (Na+) + c (H+) =c (OH-) +c (CH3COOH)+c (CH3COO-)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.02 mol·L-1
9、据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为: 2CH3OH + 3O2
+ 4OH-  2CO32- + 6H2O,则下列说法正确的是
2CO32- + 6H2O,则下列说法正确的是
A.构成该电池的正极和负极必须是两种活性不同的金属
B.充电时有CH3OH生成的电极为阳极
C.放电时电解质溶液的pH逐渐增大
D.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32- + 6H2O
8. 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此下列叙述正确的是
 A.铅笔芯作阳极,发生还原反应
A.铅笔芯作阳极,发生还原反应
B.铂片作阴极,发生氧化反应
C.铅笔尖附近有少量的氯气产生
D.红字是H+放电,破坏了水的电离平衡,c(OH-)增大造成
7.在101 kPa和25 ℃时,热化学方程式:H2(g) + 1/2O2(g) =H2O(g)△H=-241.8 kJ/mol,H2(g) + 1/2O2(g) =H2O(1);△H=-285.8 kJ/mol。下列说法中错误的是
A. H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B. H2的燃烧热为285.8 kJ
C. O2 前面的1/2表示参加反应的O2的物质的量
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
6.用锌和1 mol/L稀硫酸溶液制取氢气,欲提高制取氢气的速率,下列措施不可行的是
A.改用98%的浓硫酸 B.使用更小颗粒的锌粒
C.滴入少量CuSO4溶液 D.加热
5.常温时,将足量的AgCl固体分别加入同体积的下列各溶液中,溶解的AgCl最少的是
A.1 mol·L-1的MgCl2溶液 B.2 mol·L-1的NaCl溶液
C.1.4 mol·L-1的BaCl2溶液 D.1 mol·L-1的AlCl3溶液
4.下列各组物质中,都是强电解质的是
A.HBr、HCI、BaSO4 B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2O D.HClO、NaF、Ba(OH)2
3.相同温度下等物质的量浓度的下列溶液中,c(NH4+)最大的是
A. B.
B.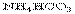 C.
C. D.NH3.H2O
D.NH3.H2O
2.下列说法正确的是
A.KW随浓度的改变而改变 B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 D.一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱
1.下列说法正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C.在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com