
2. 如果上图位于北半球,下列地理现象可能出现的是( )
A.此时太阳直射点位于20°S B.长江正值汛期
C.松花江正值枯水期 D.巴西高原草木繁茂
图中MN为晨昏线,阴影与空白区域分属两个不同的日期,图中相邻两条经线经度差为30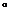 ,读图回答l-2题。
,读图回答l-2题。
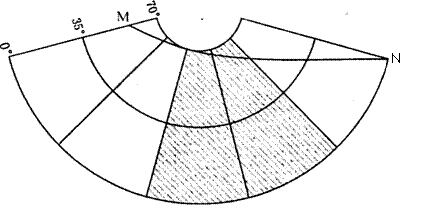
1. 如果上图位于为南半球,此时北京时间为 )
A.0时 B.8时 C.12时 D.16时
24. (17分)计算并填空:
(1) Al单质晶体中其晶体最小重复单元特征如下图所示,请回答:
晶体中距离Al原子最近的A1原子为__________个,一个最小单元结构中Al原子的数目为______________。
(2) 高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的制备是用硝酸铁、氢氧化钠和氯气共同反应制得的。请配平下列方程式:
□Fe (NO3)3 +□NaOH +□Cl2→□Na2FeO4 +□NaNO3 +□NaCl+□H2O
反应中氧化剂为_____________,2mol Fe (NO3)3参加反应时转移电子数为_______mol。若用石墨作电极电解0.1L的NaCl溶液,通电一段时间后,阴极收集到气体11.2L,阳极收集到气体6.72L ,则原溶液中NaCl的物质的量浓度为__________mol/L;若利用上述反应得到了等质量的NaCl,同时得到高铁酸钠的质量为_________g。
(3) ①已知:H2(g) + 1/2O2(g) = H2O(l);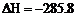 kJ/mol
kJ/mol
H2(g) = H2(l);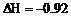 kJ/mol
kJ/mol
O2(g) = O2(l);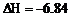 kJ/mol
kJ/mol
请写出液氢和液氧生成液态水的热化学方程式:________________________________。
②有关键能数据如表:
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)
+ O2(g) = SiO2(s),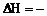 989.2
kJ·mol-1,则Si-O键的键能X的值为__________kJ·mol-1。
989.2
kJ·mol-1,则Si-O键的键能X的值为__________kJ·mol-1。
西南师大附中2008-2009学年度下期期末考试
23. (13分) 用如下步骤测定Na2SO4·xH2O晶体中x的值:
①称量质量为W1 ②称量质量为W2
③称量质量为W3 ④称量质量为W4
⑤研细 ⑥加热灼烧 ⑦冷却 ⑧计算
已知: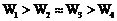
(1) 用序号表示实验步骤:⑤→_____________________________________________→⑧。
(2) 用于加热灼烧所需要的主要盛装仪器是_____________,冷却时必须置于_______________冷却。
(3) 最后两次称量的目的是__________________________________________________。
(4) 请计算出该晶体化学式中x 的值,x=________________________。
(5) 下面情况可能造成测试结果偏高的是_____________。
A.试样中含有加热不挥发的杂质 B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水 D.实验前坩埚未完全干燥
E.晶体加热脱水完全 F.加热时晶体溅出
22. (13分) 碳、氢、氧3种元素组成的有机物A,相对分子质量不大于150,其中氧元素的质量分数为31.37%,且有两种不同的含氧官能团。
(1) A的分子式是________________。
(2) 一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外两个相同的基团。
①A的结构简式是______________________________。
②A不能发生的反应_____________________。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应 e.氧化反应
③写出A与银氨溶液反应的离子方程式:
______________________________________________________________________。
(3) A的一种同分异构体B,已知:B不能发生银镜反应,且在酸性条件下水解产生两种直链化合物,它们的相对分子质量相差28。
①写出B的结构简式_______________________________。
②请设计合理的方案以乙醇为原料合成B(用合成路线流程图表示,并注明反应条件):
提示:①R-Br + NaCN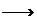 R-CN + NaBr;②R-CN
R-CN + NaBr;②R-CN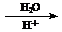 R-COOH
R-COOH
③合成过程中无机试剂任选;
④合成路线流程图示例写法如右:
 CH3CH2OH
_______________________________________________________
CH3CH2OH
_______________________________________________________
__________________________________________________________________________________________________________________________________________________
21. (14分) 苄佐卡因是一种医用麻醉药口,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要原料经下列反应制得:
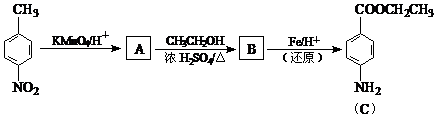
提示: 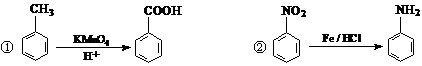
请回答下列问题:
(1) 写出A、B的结构简式:A______________、B______________。
(2) 用1H核磁共振谱可以证明化合物B中有______________种氢处于不同的化学环境。
(3) 写出同时符合下列要求的化合物B的所有同分异构体的结构简式(B1、B2、B3除外)________________________________。
①化合物是1,4一二取代苯,其中苯环上的一个取代基是硝基
②分子中含有酯基
注:B1、B2、B3结构如下:
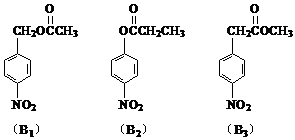
(4) B1、B2、B3中有一化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,写出该化合物在NaOH溶液中的水解反应的化学方程式_____________。
(5) 苄佐卡因(C)的水解反应如下:
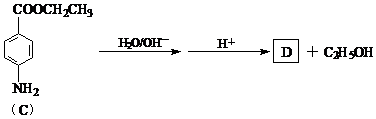
化合物D经聚合反应可制成高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该反应的化学方程式__________________________________________________。
20. (8分) 试回答下列问题:
I.甲、乙两种元素是同一周期的相邻元素,乙元素的原子的最外层有5个电子,甲元素有多种同素异形体,其中一种能导电。
若由甲、乙两元素形成的一种化合物硬度比金刚石大,则该化合物属于___________晶体,其化学式为____________,若要使其熔化,需破坏的化学键为_________________。
II.人们一直致力于人工固氮的研究以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示。图中左右两边对称,各含一个近似立方体的结构。每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键。

请在图中左边立方体的○内填写出其余3个Fe原子。
上述一个立方体中4个Fe原子所在顶点连接所构成的空间几何体为_____________。
19. (13分) 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
⑤ |
|
|
3 |
⑥ |
|
|
⑦ |
|
|
⑧ |
|
(1) ②和⑦形成的化合物属于_____________晶体;在⑦单质所形成的晶体中,每个原子周围与_________个原子形成______________结构。
(2) ②、④、⑤的气态氢化物的沸点由高到低的顺序为________________________。
(3) ①、④、⑥、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4) ①和③形成的相对分子质量为32的一种化合物是火箭发射的燃料之一,名肼,3.2g液态肼和足量氧气燃烧生成③的单质和另一种液态化合物时放出969.0kJ的热量,请写出该反应的热化学方程式:______________________________________;若利用该反应形成燃料电池,以NaOH溶液为电解质,则负极反应式为____________________。
18. 下列反应的化学方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++ 3H2O
 Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B.在苯酚钠溶液中通入二氧化碳气体 2C6H5O-+ CO2 + H2O→2C6H5OH + CO32-
C.等物质的量浓度的ZnBr2和CuCl2混合溶液用惰性电极电解,最初发生:
Cu2+ + 2Br-
 Cu + Br2
Cu + Br2
D.甲醇的燃烧热的热化学方程式:
CH3OH(l) +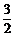 O2(g)
= CO2(g) + 2H2O(g);
O2(g)
= CO2(g) + 2H2O(g);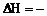 726.5kJ·mol-1
726.5kJ·mol-1
第Ⅱ卷 非选择题(共78分)
17. 下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,SO42-向电解池阴极移动
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.在锌铜原电池中,锌不会被腐蚀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com