
【题目】(1)明明用配制的氢氧化钠溶液做中和反应实验,发现有气泡产生。于是明明判断氢氧化钠变质了。请用化学方程式说明氢氧化钠变质以及滴加盐酸产生气泡的原因_____。
(2)为探究氢氧化钠是否完全变质,明明设计了两个实验方案。
方案1:取少量上述氢氧化钠溶液样品,滴加几滴酚酞溶液,溶液变成红色。
方案2:取少量上述氢氧化钠溶液样品,加入饱和石灰水,静置,取上层清液,滴加几滴酚酞溶液。发现溶液变成红色。于是明明认为样品中还会有氢氧化钠,没有完全变质。康康认为明明的两个实验方案都不能达到目的,他的理由是_____;_____。
请你设计一个方案来验证氢氧化钠是否完全变质_____。
(3)康康将方案 2 进行了定量化处理,来检测氢氧化钠固体的变质程度。取 10 g 样品溶于 90 g水中,向其中滴加过量饱和石灰水,对沉淀过滤、洗涤、烘干后称量为 0.5 g。则样品中氢氧化钠的质量分数是多少?_____
【答案】2NaOH+CO2═Na2CO3+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑ 可能是氢氧化钠也可能是碳酸钠使酚酞变红 氢氧化钙会与碳酸钠反应产生氢氧化钠,能使酚酞试液变红 取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液,静置,取上层清液,滴加几滴酚酞试液,发现溶液不变色 94.7%
【解析】
(1)氢氧化钠变质是因为氢氧化钠能与二氧化碳反应生成碳酸钠和水,滴加盐酸产生气泡是因为碳酸钠能与盐酸反应产生氯化钠、水和二氧化碳,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)方案1:碳酸钠溶液和氢氧化钠溶液均显碱性,都可以使无色酚酞变红。取少量上述氢氧化钠溶液样品,滴加几滴酚酞溶液,溶液变成红色,可能是氢氧化钠也可能是碳酸钠使酚酞变红;
方案2:取少量上述氢氧化钠溶液样品,加入适量饱和石灰水,氢氧化钙会与碳酸钠反应产生氢氧化钠,能使酚酞试液变红;因此明明认为样品中还有氢氧化钠,样品没有完全变质的说法是错误的;
要设计一个实验方案来验证氢氧化钠是否完全变质,可以取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(目的是除尽碳酸钠),静置,取上层清液,滴加几滴酚酞试液,发现溶液不变色,说明无氢氧化钠存在,样品已经完全变质;
(3)设样品中碳酸钠的质量为x,
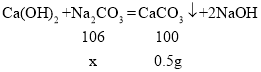
![]()
x=0.53g
故样品中氢氧化钠的质量分数是:![]() ×100%=94.7%。
×100%=94.7%。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:初中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验方案,各步操作流程如下:
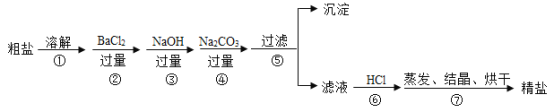
⑴在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是_________________。
⑵第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2 ___________(填化学式)。
⑶在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是____________。
⑷在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是____________。
⑸实验所得精盐的质量大于粗盐中的NaCl的质量,原因是_____________。
⑹某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如下图。
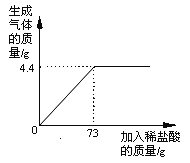
①纯碱恰好完全反应时,生成CO2的质量为___________g。
②计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学源于生活,服务于生活。做生活的有心人,你会体会到学习和生活的乐趣。让我们一起体会“生活中的化学”。
(1)“衣”:纺织、印染要用到氢氧化钠,该物质的溶液要密封保存,原因是_______;
(2)“食”:农作物的生 长对土壤的酸碱性有一定的要求,酸性土壤中,将适量的______(填俗名)加入土壤,以利于作物生长;
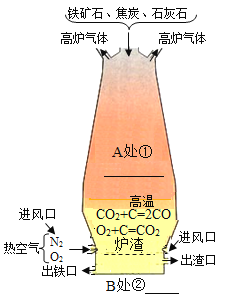
(3)“住”:我们住的房子离不开金属铁,右图是炼铁高炉及炉内化学反应示意图:A处的化学方程式______;B处出铁口的物质为_____,原料中石灰石的主要作用_____;
(4)“行”:路两边的大树常涂刷含有硫磺粉的石灰浆,作用是:保护树木,_______。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钡是一种可溶性重金属盐,广泛应用于化工领域,用毒重石(主要成分为BaCO3)制备氯化钡晶体工艺流程如下:
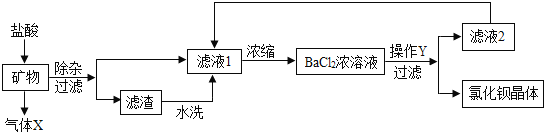
(1)毒重石要进行粉碎的目的是____________。产生气体X的化学方程式为________________。若所得滤液1仍浑浊,则应采取的操作是_______;
(2)操作Y的名称是_________。滤液2中可循环利用的物质除水外还有________。
洗涤氯化钡制品最适宜的洗涤剂是____________(填标号)。
A30℃水 B30℃饱和氯化钠溶液 C30℃饱和氯化钡溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体的溶解度曲线。将t3℃时相同质量的甲、乙两种物质的饱和溶液降温到t1℃,只有甲的溶液中有固体析出。则乙的溶解度曲线为(填“X”或“Y”);甲和乙的溶解度相等时的温度为_______;t3℃时,将30 g 甲的饱和溶液稀释为质量分数为10%的溶液,需加水的质量为________g。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室制取气体的部分装置,请根据你所学知识回答问题。
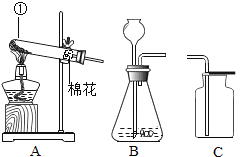

(1)实验室用A装置来制取氧气的化学方程式是_____。
(2)确定实验室制取气体的发生装置时,你认为应考虑的因素有_____。
(3)实验室使用B装置制取氢气,用装置E和F组合不但能收集到比较纯净的气体,还可以测量出收集到的气体的大约体积,气体应从_____(填“b”或“c”)端进入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产氯化钙晶体的流程如下。原料石灰石中含有杂质主要是MgCO3、MgSO4 和Al2O3。
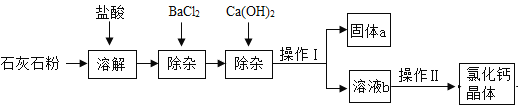
⑴石灰石粉溶解时,Al2O3发生反应的化学方程式为________________。
⑵加入BaCl2除去的杂质离子是____________(填离子符号);
⑶操作Ⅰ的名称为____________,需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、____________。操作Ⅱ的具体步骤为:____________、冷却结晶。
⑷固体a的成分一定含有________________________(只写一种)。检验溶液b的酸碱性,如果显碱性,还需加入适量的____________ (填化学式)提高产品纯度。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钙是一种重要化工原料,广泛用于建筑、造纸、食品和医药等工业。
Ⅰ 高纯碳酸钙的制备
一种以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂质]为原料制备高纯CaCO3的流程如下:
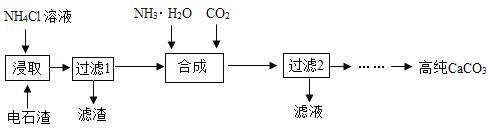
(1)“浸取”的主要目的是将Ca(OH)2转变成CaCl2,同时还产生有氨味的气体)。“浸取”时反应的化学方程式为_____。
(2)“过滤2”得到的滤液中一定含有的物质是_____(填化学式)。
Ⅱ 碳酸钙的应用
(3)大理石主要成分为CaCO3,另外还含有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
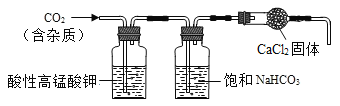
①装置中的酸性高锰酸钾用于除去CO2气体中的含硫化合物,饱和NaHCO3溶液是用于除去CO2气体中的______,CaCl2固体用于干燥CO2。
②实验室常用______检验CO2气体,实验现象为_____。
(4)工业上用石灰石浆吸收废气中的二氧化硫并制取石膏(主要成分为硫酸钙)的流程如下图。

已知反应吸收塔里的反应为:2CaCO3+2SO2+O2=2CaSO4+2CO2。
①流程中石灰石加水制成石灰浆的目的是_____。
②反应前后硫元素的化合价______(填“升高”或“降低”),氧元素的化合价______(填“升高”或“降低”),该反应属于氧化还原反应。
③减少二氧化硫的排放,主要为了______(填序号)。
A 减缓温室效应 B 减少酸雨形成 C 防止破坏臭氧层
④按上述方法处理2000吨废气中的二氧化硫,至少需要含5吨碳酸钙的石灰石浆。废气中二氧化硫的质量分数为______。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com