
| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢禅的粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/g(标况下) | 1.120 | 2.240 | 2.800 |
分析 (1)根据Fe2O3的分子式计算出铁元素的质量分数,然后求得6.62g铁矿石中铁的质量;再根据已知条件“若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%)”计算生产1.00t生铁需铁矿石的质量;
(2)①钢样中的C元素燃烧后生成二氧化碳,二氧化碳通入澄清石灰水生成了碳酸钙沉淀,根据化学变化中元素质量不变,碳酸钙中所含C元素质量即钢样中C元素质量;由此可完成此钢样粉末中铁和碳的质量之比的计算;
②分析表中所记录实验数据,可得知在第III次实验中稀硫酸完全反应,根据反应的化学方程式.由生成氢气质量计算50g稀硫酸中硫酸的质量,解决硫酸中H2SO4的质量分数.
③要分类讨论:当Fe完全反应;当Fe过量时.
解答 解:(1)解:6.62g铁矿石中铁的质量为mFe=4.80g×$\frac{2×56}{2×56+16×3}×100%$=3.36g
生产1.00t生铁需铁矿石的质量为:m铁矿石=$\frac{1.00t×96%×\frac{6.62g}{3.36g}}{1-4%}$≈1.97t
答:至少需要这种铁矿石1.97t
故填:1.97.
(2)①根据题意知,该白色沉淀是CaCO3,所以C的质量=$\frac{12}{100}$×100%×1g=0.12g;
故此钢样粉末中铁的质量=28.12g-0.12g=28g;
所以此钢样粉末中铁和碳的质量之比=28:0.12=700:3;
②设50g稀硫酸中溶质的质量为x
Fe+H2SO4=FeSO4+H2↑
98 2
x $\frac{2.800}{22.4}×2g$=0.25g
$\frac{98}{x}=\frac{2}{0.25g}$
x=12.25g
稀硫酸中H2SO4的质量分数为:$\frac{12.25g}{50g}$×100%=24.5%
③当钢样粉末中的铁末全部溶解时(m>1.406g),剩余的固体质量为:(5.624g+mg)-0.125mol×56g•mol-1=(m-1.376)g
当钢样粉末中的铁全部溶解时(m≤1.406g),
剩余的固体质量为:(5.624+m)g×$\frac{0.12g}{28.12g}$;
答:①此钢样粉末中铁和碳的质量之比是700:3;
②稀硫酸中H2SO4的质量分数是24.5%;
③当m>1.406 g,剩余固体质量为:(m-1.376)g;
当 m≤1.406 g,剩余固体质量为:(5.624+m)×$\frac{0.12}{28.12}$g.
点评 根据实验数据中钢样质量的增加值与反应产生氢气的质量增加值的关系,判断实验III中稀硫酸完全反应是计算稀硫酸溶质质量分数的根本.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
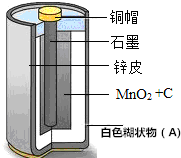 小意对自己使用的一节废旧干电池进行了系列探究;
小意对自己使用的一节废旧干电池进行了系列探究;查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
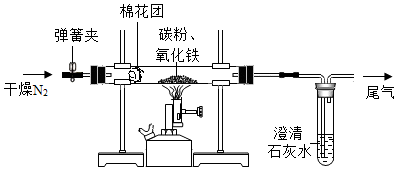
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 任意比 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
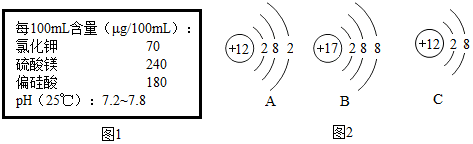
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 温度不变,添加水 | B. | 温度不变,蒸发水 | ||
| C. | 水量不变,升高温度 | D. | 降低温度,且加氢氧化钙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com