
【题目】在氢氧化钠溶液中加入 X 溶液并插入温度计,逐滴加入硫酸溶液,观察到红色褪去,温度计示数上升。证明碱与酸能发生反应,且放出热量。
(1)加入的 X 溶液应该是_____溶液;
(2)甲同学提出滴入的硫酸不能用浓硫酸,他的理由是_____;
(3)乙同学提出红色褪去不能说明酸和碱恰好反应完全,为了证明是否恰好反应,可取上述反应后的无色溶液少许加入_____即可(填序号)。
①铜 ②镁 ③氧化铜 ④BaCl2 溶液 ⑤Na2CO3 溶液
(4)若取10%的氢氧化钠溶液100g和10%的硫酸溶液100g混合后,加入紫色石蕊,则此时溶液呈_____色(填序号)。
①紫 ②红 ③蓝
【答案】无色酚酞 浓硫酸溶于水放出大量的热 ②③⑤ ③
【解析】
(1)在氢氧化钠溶液中加入X溶液并插入温度计,逐渐滴加硫酸溶液,观察到红色褪去。无色酚酞溶液遇碱性溶液变红色,则加入的X溶液应该是无色酚酞溶液。故答案为:无色酚酞;
(2)浓硫酸溶于水会放出大量的热,不能确定产生的热量是浓硫酸稀释形成的,还是酸碱中和反应形成的。故答案为:浓硫酸溶于水放出大量的热;
(3)溶液中红色褪去能证明溶液不呈碱性,可能是酸性或中性。溶液呈酸性时,溶质是硫酸钠和硫酸。溶液呈中性时,溶质是硫酸钠。
①铜:铜不和硫酸反应,加入后,无明显现象,无法区分。①错误;
②镁:镁和硫酸反应生成氢气,能观察到溶液中有气泡产生。有气泡产生,则为酸过量,若没有气泡产生,则恰好完全反应。②正确;
③氧化铜:氧化铜和硫酸反应生成硫酸铜和水,能观察到氧化铜逐渐溶解,溶液由无色变为蓝色。有明显现象,则为酸过量,若无明显现象,则恰好完全反应。③正确;
④氯化钡溶液:氯化钡溶液和硫酸钠反应生成硫酸钡沉淀和氯化钠。氯化钡溶液和硫酸反应生成硫酸钡沉淀和盐酸。无论是酸过量还是恰好完全反应,始终都能观察到有白色沉淀产生,无法正确判断。④错误;
⑤碳酸钠溶液:碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,能观察到溶液中有气泡产生。有气泡产生,则为酸过量,若没有气泡产生,则恰好完全反应。⑤正确。
故答案为:②③⑤;
(4)100g、10%的氢氧化钠溶液硫酸溶液的溶质质量为:100g×10%=10g。根据化学反应方程式可知,消耗的硫酸与氢氧化钠的质量比关系如下:
![]()
由此可知,98份质量的硫酸与80份质量的氢氧化钠恰好完全反应。则100g、10%的氢氧化钠溶液和硫酸溶液混合后,氢氧化钠有剩余,则溶液呈碱性。紫色石蕊试液遇碱性溶液变蓝。故答案为:③。


科目:初中化学 来源: 题型:
【题目】AE 为初中化学五种不同类别的常见物质。已知 C 含有三种元素,E 为世界年产量最高的金属,A 是相对分子质量为 160 的蓝色溶液。它们之间相互关系如图所示,图中“”表示相连的物质能相互反应,“→”表示种物质转化成另一种物质(部分反应物、生成物及反应条件已略去)。请回答下列问题:
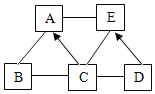
(1)物质 E 是_____。
(2)写出下列反应的化学方程式:A+E:__________;B+C:________________。
(3)图中相互关系涉及基本反应类型有_____种。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对久置于空气中的“生石灰”干燥剂的组成成分及含量进行探究
(查阅资料)Ca(OH)2加热到一定温度时会发生分解反应,生成两种氧化物。
(实验探究)该小组称取15.2g干燥剂样品于控温电加热器中,按如图所示装置进行实验(装置气密性良好,A、B、C中药品足量,实验操作正确)
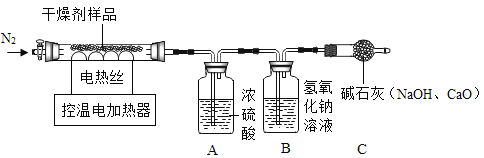
(数据记录)充分反应后,产物被完全吸收,A装置增重1.8g,B装置增重2.2g。
(分析结论)该包干燥剂的成分是_____(填化学式),
(数据处理)该15.2g干燥剂样品,若加入过量稀盐酸后,蒸发至干,得到氯化钙固体质量是_____g。
(反思拓展)①停止加热后,需要通入N2一段时间的目的是_____。
②若没有C装置,会导致含量测定结果偏小的成分是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】T1℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到T1℃,现象如图1、2所示。下列说法正确的是
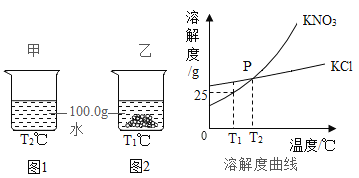
A.甲中加入的固体是KCl
B.T1℃时,甲中溶液一定是该溶质的不饱和溶液,乙中上层清夜一定是该溶质的饱和溶液
C.将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁及其化合物的有关知识
(一)铁及其化合物的应用
1如图1为某小儿硫酸亚铁糖浆。适当服用该糖浆可治疗_____(选填序号)。
A佝偻病
B侏儒症
C贫血症
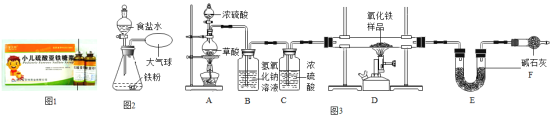
2食品保鲜“双吸剂”含铁粉、食盐等,如图2为其原理探究实验: 滴入食盐水后,关闭分液漏斗活塞。一段时间后,铁粉上出现红色固体,气球_______(选填“变大”、“不变”或“变小”)。食盐水的作用是_______。
(二)铁及其化合物的实验
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
[查阅资料]:
草酸(H2C2O4) 固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:
②NaOH溶液可以吸收二氧化碳,浓硫酸是一种常用的干燥剂,碱石灰既能吸收二氧化碳也能吸水。于是他设计了如图3的实验装置,结合装置回答下列问题:
1图中装置C作用是______;
2从实验操作程序和实验安全看,首先要检查装置的气密性,实验开始先加热_______(填A或D)处。
3该装置设计有一个明显缺陷,你认为是_______。
4将Fe粉溶于稀H2SO4,用点燃法检验生成的H2前必须_____。向反应后的溶液中滴加NaOH溶液,生成白色Fe(OH)2沉淀,随后沉淀变为灰绿色。白色沉淀变为灰绿色的原因之一是部分Fe(OH)2接触空气生成Fe(OH)3,反应的化学方程式_____。生成的Fe(OH)3分解为Fe2O3。过滤、洗涤、低温干燥得到灰绿色固体,其组成为2FeSO4·2Fe(OH)2·Fe2O3[相对分子质量为644]。
(三)灰绿色固体的热分解实验
兴趣小组称取此固体6.44g,在科研人员的指导下用下图装置进行热分解实验。
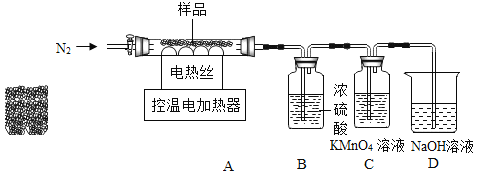
[查阅资料]①Fe(OH)2在150℃~200℃时完全分解为FeO;
②FeSO4在450℃~ 500℃时完全分解为Fe2O3,
![]()
1加热前后及过程中均通入N2,加热结束后仍通一段时间N2的目的是________。
2控制温度在不同的范围对A中样品加热。测得剩余固体质量随温度的变化如图所示。B装置中浓硫酸只能吸收SO3和H2O,当加热到t1℃时,装置C中的现象为______。
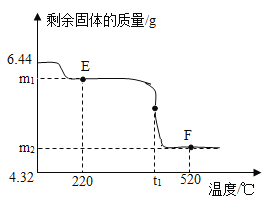
①图中E点对应的m1=_____。
②图中F点对应物质中Fe2O3的质量为___g。
③科研人员将F点所得剩余固体隔绝空气,在密闭容器中加热到1400℃,已知加热过程中发生反应,且反应前后固体总质量不变,得到纯净的化合物。请写出该化合物的化学式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体的常见发生装置,回答下列问题。
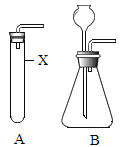
(1)图中仪器X的名称是___________________。
(2)若B中加入锌粒和稀硫酸,写出反应的化学方程式______________。
(3)从反应物状态和反应条件来看,装置A和B都可以用于制氢气,理由是______________;与A相比,装置B优点有______________(回答一点即可)。
(4)实验室还可以用装置B制取的气体是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学反应有不同的分类方法,关于下列反应变化说法正确的是( )
①2H2O![]() 2H2↑+ O2↑ ②8A1+3Fe3O4
2H2↑+ O2↑ ②8A1+3Fe3O4![]() 4A12O3 +9Fe ③CH4+2O2
4A12O3 +9Fe ③CH4+2O2![]() CO2+2H2O
CO2+2H2O
A.①属于化合反应B.②属于置换反应
C.③属于复分解反应D.③属于吸热反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,据图回答下列问题。
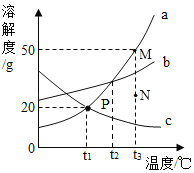
(1)t1℃时,把80g物质a加入到20g水中充分搅拌、静置,形成的是______溶液(填“饱和”或“不饱和”)。
(2)欲使a物质的溶液从M点转化为N点,可采取的措施是_____________。
(3)将P点对应的c物质的溶液升温到t 3℃,其溶质质量分数____(填写“变大”、“变小”或“不变”)。
(4)将t3℃时a、b、c三种物质的饱和溶液恒温蒸发相同质量的水,析出晶体的质量最小的是____(填物质序号)。
(5)t3℃时,将等质量的a、b、c三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为___________。
(6)“P”点的意义为___________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生产和生活中有广泛的应用。
(1)下列金属制品中,利用金属导电性的是______(填字母序号)

(2)收藏家收藏清朝末年的铝制品至今仍保存完好,原因是在常温下,其表面形成了一层致密的氧化铝薄膜: (用化学方程式表示)_________
(3)铁制品在沙漠地区不易锈蚀的原因是_________
(4)人们在焊接铁制品时先要用稀盐酸处理一下表面的铁锈,其原理是(用化学方程式表示):_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com