
【题目】兴趣小组的同学对金属的某些性质进行相关探究。
(实验回顾)
(1)如图所示,将两块金属片进行相互刻划。该实验的目的是_____。
(2)用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜着(资料:铝的熔点660℃,氧化铝的熔点2054℃。)。请解释原因_____。
(实验探究)铝与氯化铜溶液的反应

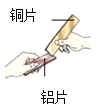
将打磨过的铝片放在15%氯化铜溶液中,观察到铝片表面逸出大量无色气体,且附着红色物质,过一段时间还有白色沉淀产生。利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示)。
(实验反思)
(1)写出生成红色物质的化学方程式为_____。
(2)结合图1分析,铝和氯化铜溶液反应生成的无色气体是_____(填名称)。
(提出问题)白色沉淀的化学成分是什么?
(查阅资料)
①氢氧化铝、氯化亚铜(CuCl)均是难溶于水的白色固体。
②CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl—。
③Cu(NH3)2+在空气中易被氧化变为蓝色;Cl—可与硝酸银溶液反应,产生白色沉淀。
(实验方案)将上述实验中产生的沉淀过滤出来,并洗涤干净后,加入浓氨水,沉淀部分溶解得到无色溶液,将无色溶液分为两份,进行实验。
操作步骤 | 实验现象 | 实验结论 |
用试管取其中一份溶液,滴加适量AgNO3溶液 | _____ | 该溶液中含有Cl— |
将另一份溶液置于空气中一段时间 | _____ | 该溶液中含有Cu(NH3)2+ |
(实验结论)通过实验可以确定,该白色固体是CuCl。
(反思与评价)
(1)小组同学将Cu粉与15%CuCl2溶液混合,没有观察到白色沉淀。在老师的启发下,结合图2“温度-时间变化曲线”,对实验进行改进,确证了Cu与CuCl2溶液反应生成CuCl。请你写出改进后的实验方案是_____。
(2)经过讨论CuCl是Cu与CuCl2化合反应生成。
(思维拓展)
(1)金属锌、铜和稀硫酸构成化学电池(如图)。观察到铜片表面有气泡(H2),小电珠发光、烧杯中溶液始终无色。下列关于实验的分析不正确的是_____(填序号)。
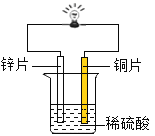
A 铜与稀硫酸发生了置换反应
B 铜的金属活动性变得比锌强
C 烧杯中溶液的pH会逐渐增大
D 该装置将电能转化为化学能
(2)某工厂化验室用20%NaOH溶液来中和上图实验前烧杯中的H2SO4,共消耗NaOH溶液20g,反应后的溶液呈中性,则上图烧杯中原来所含H2SO4的质量为_____(写出计算过程)。
【答案】比较硬度 氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。 2Al+3CuCl2=3Cu+2AlCl3 氢气 生成白色沉淀 溶液变为蓝色 加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl。 ABD 4.9g(详见解析)
【解析】
[实验回顾]}
(1)如图所示,将两块金属片进行相互刻划目的比较其硬度,故填:比较硬度。
(2)氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。故用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,发现熔化的铝不滴落,好像有一层膜兜着,故填:氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。。
[实验反思]
(1)铝和氯化铜反应生成氯化铝和红色铜,化学方程式为;2Al+3CuCl2=3Cu+2AlCl3,故填:2Al+3CuCl2=3Cu+2AlCl3。
(2)溶液pH小于7呈酸性,铝和酸反应生成氢气,故生成的气体为氢气,故填:氢气。
[实验方案]溶液中含有Cl-,滴加适量AgNO3溶液会生成白色沉淀,溶液中含有Cu(NH3)2+置于空气中一段时间会变为蓝色,故填:生成白色沉淀;溶液变为蓝色。
[反思与评价]通过图2“温度-时间变化曲线”发现加入铝片之后溶液温度升高,猜想加热Cu与CuCl2反应生成CuCl,可以加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl,故填:加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl。
{思维拓展}
A、在金属活动顺序中,铜排在氢之后,铜与稀硫酸不反应,故A错误;
B、在金属活动顺序中,锌排在铜之前,锌的金属活动性比铜强,故B错误;
C、烧杯中溶液的氢离子生成氢气,酸性减弱,pH会逐渐增大,C正确;
D、该装置将化学能转化为电能,D错误。
故选:ABD。
(2)设H2SO4质量为x。

答:质量为4.9g


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】下图是实验室组装制取气体装置时,可能用到的仪器,回答问题。
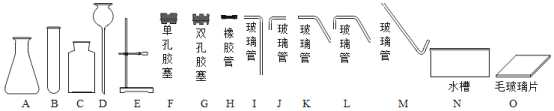
(1)写出仪器B的名称__________;
(2)实验室用大理石和稀盐酸制取CO2,发生反应的化学方程式:______,组装制取装置时,除选用A、C、G、H、L、N、O外,还需选用的仪器是__________;
(3)制取CO2气体的装置,还可用于H2O2溶液和MnO2混合制O2,但不能用于以KMnO4为原料制O2。则组装制取气体装置时,需考虑反应物状态、_________和气体的性质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜是铜和锌的合金![]() ,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
实验次数 | 一 | 二 | 三 | 四 |
黄铜样品质量/g | 1 | 2 | 3 | 4 |
生成氢气质量/g | 0.02 | 0.04 | 0.05 | M |
(1)从第_____次实验开始黄铜样品有剩余;
(2)M=_____;
(3)黄铜样品中锌的质量分数?_____(写出具体的计算过程![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中常见的物质,已知A~G七种物质均含有同一种元素, D的相对分子质量为100,可用作建筑材料。它们之间的转化关系如图所示,图中“一”表示两端物质间能发生化学反应,“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。下列说法中不正确的是
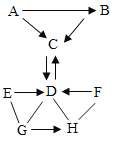
A.A为一种单质,D为碳酸钙
B.可能涉及四种基本反应类型
C.E、F的物质类别可能相同,也可能不同
D.H的浓溶液具有挥发性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。下列说法错误的是
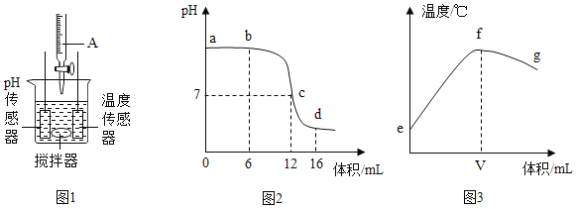
A.图2中b点所示溶液中的溶质是NaCl和NaOH
B.将图2中d点所示溶液加热蒸干所得固体为纯净物
C.图2中c→d所示溶液中NaCl的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
查看答案和解析>>
科目:初中化学 来源: 题型:
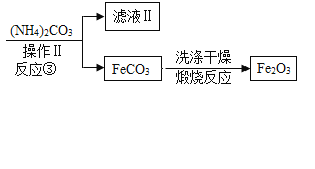
【题目】Ⅰ.高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:
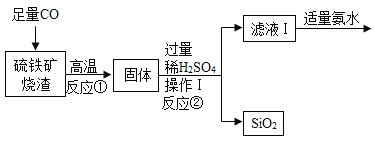
(1)操作Ⅰ和操作Ⅱ都要用到的玻璃棒,玻璃棒的作用是____________。
(2)反应②的化学方程式是____________________。
(3)反应③的基本反应类型是________________。
(4)检验滤液Ⅱ中阳离子的操作是:取样,滴加______________________溶液,微热,将湿润的红色石蕊试纸放在试管口。
Ⅱ.下图表示元素的化合价与物质类别的关系,“→”表示物质之间可以转化。A、B、C、D、E 是初中化学所学物质,分别由 Fe、H、O、Cl 中的一种、两种或三种元素组成,已知:难溶性碱加热时会生成对应的氧化物。

(1)Ⅰ题中的产物 Fe2O3 是上图中的___________物质(填序号)。
(2)B→A 的转化对应Ⅰ题中的反应___________(填序号)。
(3)C→B 的另一种生成物的化学式是__________。
(4)除了图中所示的转化关系外, 还存在哪些转化关系, 请写出对应的化学方程式___________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去下列物质中的少量杂质(括号内为杂质),所用试剂及方法正确的是( )
A.![]() 过量碳粉、灼烧
过量碳粉、灼烧
B.![]() 滴加NaOH溶液,至不再生成沉淀,过滤
滴加NaOH溶液,至不再生成沉淀,过滤
C.![]() 过量稀硫酸
过量稀硫酸
D.![]() 溶解、过滤、蒸发
溶解、过滤、蒸发
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种物质的溶解度曲线。在t2℃时往盛有100g水的烧杯中先后加入20g甲和20g乙(两种物质溶解时互不影响,且溶质仍是甲、乙),充分搅拌。将混合物的温度降低到t1℃。下列说法正确的是
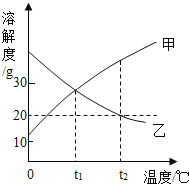
A.甲物质的溶解度受温度变化的影响较大,乙物质的溶解度受温度变化的影响较小
B.要使乙从其浓溶液中析出,可采用冷却热饱和溶液法
C.温度降低到t1℃时,甲、乙的溶质质量分数相等
D.t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com