
【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深入的探究学习。
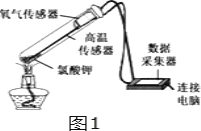
资料:
①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃。用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:

请回答问题:
(1)二氧化锰在535℃以上分解生成四氧化三锰和氧气,其反应方程式为______。
(2)分析图2,氧气的浓度随温度升高逐渐减小,在380℃突然增大的原因是______
氯酸钾分解温度______(填“高于”、“等于”或“低于”)其熔点。
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是______。
步骤 | 实验操作 | 实验现象 |
I | 检查气密性 | |
II | 分别在“Y”形管两侧支管中加入少量的二氧化锰和氯酸钾塞 紧橡皮塞 | |
III | 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在 导气管口。 | 加热左侧支管,可观察到?加热右侧支管,可观察到? |
IV | 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用 带火星木条放在导管口。 | 加热时间短于步骤III,木条很快复燃。 |
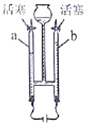
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如表所示的实验:请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到______,加热左侧试管的目的是______。加热右侧支管,可观察到______。
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是______。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的______和______不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的化学方程式为______。
【答案】3MnO2![]() Mn3O4+O2↑ 温度升高,气体膨胀,氧气浓度变小 高于 质量比越小,分解温度越低(或“质量比越大,分解温度越高”) 带火星的木条不复燃 证明在酒精灯加热下 MnO2 不分解 KClO3 融化为液态,带火星的木条复燃 将“Y”形管向右倾斜 质量 化学性质 2KClO3
Mn3O4+O2↑ 温度升高,气体膨胀,氧气浓度变小 高于 质量比越小,分解温度越低(或“质量比越大,分解温度越高”) 带火星的木条不复燃 证明在酒精灯加热下 MnO2 不分解 KClO3 融化为液态,带火星的木条复燃 将“Y”形管向右倾斜 质量 化学性质 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
【解析】
(1)二氧化锰在535℃以上分解生成四氧化三锰和氧气,其反应方程式为3MnO2![]() Mn3O4+O2↑;
Mn3O4+O2↑;
(2)实验装置内的空气受热膨胀,会发生逸出,导致装置内的氧气浓度降低,所以在KClO3分解前,氧气的浓度随温度升高逐渐减小,在380℃时装置内原有的含氧气浓度较低的空气被排尽,但氯酸钾分解分解生成氧气,所以装置内氧气的浓度突然增大;通过图中的数据可知氯酸钾的分解温度大约是380℃,以及氯酸钾的熔点是356℃,所以KClO3分解温度高于其熔点;
(3)通过分析图3中氯酸钾的分解数据可知,KClO3分解温度随物质配比变化的规律是质量比越小,分解温度越低(或“质量比越大,分解温度越高”);
(4)氯酸钾单独受热分解生成的氧气速率较慢,单独加热二氧化锰不会生成氧气,二氧化锰可以加快氯酸钾的分解速率,所以
步骤 | 实验操作 | 实验现象 |
Ⅰ | 检查气密性 | |
Ⅱ | 分别在“Y”形管两侧支管中加入少量MnO2和KClO3,塞紧橡皮塞。 | 没有明显现象 |
Ⅲ | 分别先后加热MnO2和KClO3,用带火星木条放在导管口.加热右侧支管后,带火星木条复燃。 | 木条长时间才能复燃 |
Ⅳ | 冷却后,将“Y”形管左侧支管中部分MnO2混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 | 加热时间短于步骤Ⅲ,木条即复燃 |
①步骤Ⅲ中加热左侧支管后,带火星木条复燃,带火星的木条不复燃;加热左侧试管的目的是证明在酒精灯加热下 MnO2 不分解。加热右侧支管,可观察到KClO3 融化为液态,带火星的木条复燃 ;
②步骤Ⅳ中,将MnO2混入右侧支管有余热的KClO3中的操作方法是:将Y形管向右倾斜,使二氧化锰进入右边的支管中;
③在化学反应里能改变其他物质的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质叫做催化剂,所以步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,还需证明在此反应中MnO2的质量和化学性质不变;氯酸钾在二氧化锰的作用下分解,生成氧气、氯化钾,反应方程式为2KClO3 ![]() 2KCl+3O2↑。
2KCl+3O2↑。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:初中化学 来源: 题型:
【题目】为了检测石灰石样品中碳酸钙的含量,甲、乙、丙、丁四位同学分别用质量分数相同的盐酸与样品充分反应进行实验测定。已知,样品中的杂质不溶于水,且不与盐酸反应。测得数据如下表:
甲 | 乙 | 丙 | 丁 | |
所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
请回答:
⑴ 样品中碳酸钙的质量分数是_______;
⑵10.0 g样品与45.0 g盐酸充分反应后,盐酸是否还有剩余_______(填“是”或“否”);
⑶10.0 g样品与足量稀盐酸反应后可产生二氧化碳_____克?(写出计算过程,计算结果精确到0.1 g)
(可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Ca—40)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从矿物中提炼金属,对人类文明的进步影响深远。

(1)孔雀石的主要成分中,含有的金属元素是______。
(2)工业上用一氧化碳和赤铁矿炼铁的化学方程式是______。
(3)矿物的储量有限且不能再生。写出保护金属资源的一条措施______。
(4)辉铜矿的主要成分Cu2S中,铜元素质量分数的计算式是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】随着经济的发展,资源、能源与环境成为人们日益关注的问题。
(1)煤、石油和_____常称为化石燃料,是不可再生的资源;燃煤发电时,将煤块粉碎成煤粉,其目的是_____。当前空气的污染主要是由于化石燃料燃烧造成的,气体污染物主要是_____。化石燃料燃烧都会产生二氧化碳是空气中含量最多的温室气体。下列措施中,有利于降低大气中二氧化碳含量的是_____。
A.大量使用化石燃料 B.植树造林,增大植被面积 C.将二氧化碳变废为宝循环利用
(2)工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是_____。
(3)水是生命之源。要确定饮用水是软水还是硬水,可用_____来检验。地球上的水储量是丰富的,但淡水很少,常用_____方法将海水淡化。电解水实验如如图所示,接通电源一段时间后,两支玻璃管中产生的气体体积比(Va:Vb)约为_____,本实验说明水是由_____组成的。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图是某反应的微观示意图,“ ![]() ”、“
”、“![]() ”、“
”、“![]() ”分别表示质子数不同的3种原子。下列有关该反应的叙述正确的是
”分别表示质子数不同的3种原子。下列有关该反应的叙述正确的是

A.乙中含有四种元素
B.反应前后分子个数不变
C.反应的本质是原子进行了重新组合
D.甲、乙相对分子质量之和等于丙、丁相对分子质量之和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某位同学在实验时的一些操作示意图,请据此回答问题:
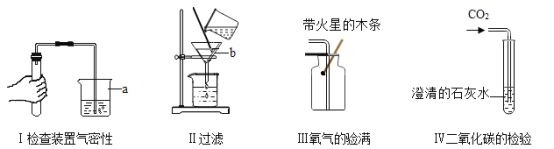
(1)图中带有标号仪器的名称分别为:a_____,b_____。
(2)上述操作中有两处错误,请改正:_____,_____。
(3)实验Ⅳ的反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组发现,“维C泡腾片”(保健品,主要成分见图1)溶于水中,有许多气泡产生(如图2)。该小组同学进行了如下探究。

(探究内容)该气体的成分
(猜想与假设)
小华说:该气体可能CO2、O2、CO、H2、N2。
小明说:不可能含有N2,因为__________。
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_____。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)(1)由实验①可知,该气体中肯定含有_____,写出该反应的化学方程式_______。
(2)由实验②_____ (填“能”或“不能”)确定该气体中不含氧气,理由是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学反应的微观示意图如下,根据该图得出的结论,正确的是( )
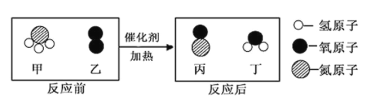
A. 四种物质中只有丁属于氧化物 B. 生成的丙和丁的分子个数比为 1:1
C. 丙物质中氮、氧元素的质量比为 7:8 D. 反应前后只有氢元素的化合价发生了变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com